Гипертиреоз – комплекс симптомов, обусловленный гиперсекрецией тиреоидных гормонов. Диффузный токсический зоб – заболевание, характеризующееся стойким патологическим повышением продукции тиреоидных гормонов - Т3, Т4 диффузно увеличенной щитовидной железой с последующим нарушением функционального состояния различных органов и систем, в первую очередь сердечно-сосудистой и центральной нервной системы.
Причины гипертиреоза
Этиологические факторы (наследственность, стрессорные и инфекционные воздействия, инсоляция) известны со времен Т. Кохера, ставшего в 1909 г. лауреатом Нобелевской премии за работы по щитовидной железе.
В последние 20 лет работы Вольпе и Маккензи выявили аутоиммунные причины гипертиреоза, что позволило говорить о диффузном токсическом зобе как об аутоиммунном заболевании, предрасположенность к которому ассоциируется с носительством определенных генов гистосовместимости (HLA B8, HLA DR3). В 15 % случаев у родственников больных диффузным токсическим зобом выявляется то же заболевание, примерно у 50 % родственников имеются циркулирующие антитиреоидные антитела. Женщины болеют в 5–10 раз чаще, чем мужчины.
Таким образом, гипертиреоз – это органоспецифическое аутоиммунное заболевание, развивающееся при врожденном дефекте иммунологического контроля. Вольпе считает, что в основе патологии – дефект Т-лимфоцитов-супрессоров, при котором происходит экспрессия DR-антигенов на поверхности тиреоцита. Антигены служат своеобразным триггерным фактором аутоиммунного процесса. Возможно образование запрещенных клонов Т-лимфоцитов, направленных против собственной щитовидной железы. Эти лимфоциты действуют на железу непосредственно, оказывая цитотоксическое действие, либо опосредованно – через В-лимфоциты, продуцирующие антитела. Уникальная особенность этих антител в их способности стимулировать функцию щитовидной железы. Данная фракция иммуноглобулинов получила названия LATS, LATS-протектор, TSI – тиреоидстимулирующие антитела. В активной фазе заболевания TSI определяются у 90 % больных диффузным токсическим зобом.
Симптомы диффузного токсического зоба
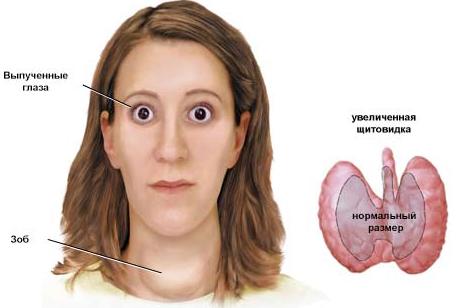
Клинические проявления гипертиреоза нередко сочетаются с поражением других органов, в первую очередь с эндокринной офтальмопатией, претибиальной микседемой, тиреоидной артропатией, реже – с сахарным диабетом 1-го типа, болезнью Аддисона, аутоиммунными поражениями печени и сосудов, болезнями крови.
Избыток тиреоидных гормонов обусловливает развитие синдрома гипертиреоза, куда входит миокардиодистрофия («тиреотоксическое сердце»), для которой характерны синусовая тахикардия, мерцательная аритмия, экстрасистолия, высокое пульсовое давление, довольно быстрое, особенное у пожилых, развитие недостаточности кровообращения.
Затем следует поражение центральной и вегетативной нервной системы (хаотичная, непродуктивная деятельность, обусловленная сочетанием повышенной возбудимости на фоне ослабления памяти, снижение способности к концентрации внимания, быстрая истощаемость, головная боль, тремор пальцев вытянутых рук, а также всего тела), некоторые так называемые глазные симптомы (симптом Дальримпля – расширение глазных щелей с появлением белой полоски между радужной оболочкой и верхним веком, Грефе – образование белой полоски между радужной оболочкой и верхним веком при движении глазного яблока вниз, Кохера – то же при движении яблока вверх, Розенбаха – мелкий тремор вокруг век, Боткина – периодическое мимолетное расширение глазных щелей при фиксации взора), связанные с воздействием тиреоидных гормонов на вегетативную нервную систему. Большая часть этих изменений обусловлена самостоятельным аутоиммунным заболеванием – ЭОП (орбитопатия Грейвса – Базедова, злокачественный экзофтальм). В крови больных появляются антитела к ретробульбарным фибробластам, синтезирующим гликозаминогликаны, которые повышают гидрофильность ретробульбарной клетчатки, вызывают отек и экзофтальм.
Согласно принятой в России классификации, выделяют 3 степени эндокринной офтальмопатии:
I – двоение отсутствует, имеется небольшой экзофтальм, припухлость век, ощущение песка в глазах, слезотечение;
II – двоение, ограничение отведения глазных яблок, парез взора кверху;
III – выраженный экзофтальм при наличии угрожающих зрению симптомов: неполное закрытие глазной щели, изъязвление роговицы, резкое ограничение подвижности глазных яблок, признаки атрофии зрительного нерва.
Нарушение иммунной системы лежит в основе так называемой претибиальной микседемы. Кожа передней поверхности голени становится отечной, уплотненной, пурпурно-красного цвета, бывают эритема и зуд. Частота патологии 2–3 %, обычно сочетается с эндокринной офтальмопатией.
Возможно, аутоиммунный генез присущ и тиреоидной остеопатии с субпериостальными разрастаниями, наиболее часто выявляемой в метакарпальных костях.
Кроме того, избыток Т3 и Т4 обусловливает катаболический синдром (похудание, миопатия, иногда остеопороз), трофические нарушения (ломкость ногтей, онихолизис, выпадение волос), синдром поражения других эндокринных желез (надпочечниковая недостаточность, нарушение толерантности к глюкозе, фиброзно-кистозная мастопатия, иногда с галактореей – у женщин, у мужчин – гинекомастия), тиреотоксический гепатит – при тяжелых формах заболевания.
У проживающих в местности с дефицитом йода гипертиреоз протекает с преимущественным выбросом Т3, что клинически проявляется приступами тахикардии или мерцательной аритмии при нормальном содержании Т4 в крови.
У пожилых больных, как правило, не бывает зоба, железа увеличена незначительно, понижен аппетит, нет типичных изменений со стороны кожи и глаз. У 13 % больных бывает эмоциональная лабильность, у 5,2 % – выраженная депрессия. В других случаях наблюдается только миопатия или лихорадка, или изолированные кардиальные нарушения.
Диагностика гипертиреоза
Диагноз диффузный токсический зоб ставят на основании клинических симптомов и данных лабораторного исследования, в первую очередь – определения в крови ТЗ, Т4. Может применяться индекс свободного тироксина, он также увеличен.
Некоторые авторы рекомендуют определение антител к тиреоглобулину, микросомальным фракциям, особенно если речь идет о дифференциальном диагнозе с нетиреоидной патологией.
Для динамического наблюдения за размерами и морфологией щитовидной железы рекомендуется УЗИ, которое, однако, не всегда может заменить сканирование. Сканирование и УЗИ не являются методами диагностики собственно диффузного токсического зоба и используются по показаниям. В редких случаях может быть использован тест с тиролиберином.
При дифференциальной диагностике эндокринной офтальмопатии и других поражений орбиты используют компьютерную томографию и УЗИ орбиты. При этом утолщение ретробульбарной мускулатуры выявляют даже при отсутствии клинических признаков эндокинной офтальмопатии.
К числу заболеваний, сопровождающихся синдромом гипертиреоза, помимо диффузного токсического зоба, относится токсическая аденома (болезнь Плюммера), токсический многоузловой зоб (болезнь-синдром Marine – Lenhart), а также более редкие формы гипертиреоза – артифициальный, обусловленный приемом тиреоидных гормонов с целью симуляции или по косметическим соображениям, продукция тиреоидных гормонов эктопированной в яичник щитовидной железой (struma ovarii ), фолликулярный рак щитовидной железы, гормонально-активные аденомы гипофиза, подострый тиреоидит, кордарон-индуцированный тиреотоксикоз, гипертиреоз, развивающийся на фоне приема йод-содержащих фармакологических и контрастных веществ, поливитаминов, бензиодарона.
Высокий уровень Т4 обнаружен у находящихся в тяжелом состоянии пожилых больных с выраженной декомпенсацией соматического заболевания.
Дифференциально-диагностическими признаками токсической аденомы являются: отсутствие экзофтальма, увеличение одной доли железы при пальпации, УЗИ и сканировании. Особенно показательна проба с внутримышечным введением тиреотропного гормона (ТТГ) и повторным сканированием (ранее не визуализирующаяся доля поглощает изотоп и четко изображается на сканограмме).
Лечение при диффузном токсическом зобе
Лечение диффузного токсического зоба складывается из использования тиреостатических препаратов, хирургического лечения с предшествующей подготовкой антитиреоидными средствами и лечения радиоактивным йодом.
В большинстве случаев лечение консервативное. В России больные получают лечение тиреостатическими препаратами (чаще Мерказолилом, реже Пропицилом). Тиреостатические препараты не только угнетают внутритиреоидный гормоногенез, но и влияют на иммунные показатели (клеточный иммунитет), а пропицил изменяет и периферическую конверсию Т4, приводя к образованию биологически неактивного «реверсивного» Т3.
Средняя доза Мерказолила составляет 30–40 мг/сут, при тяжелой форме (поражение сердца, печени) – до 60 мг/сут. Обязателен контроль уровня лейкоцитов 1 раз в неделю, при развитии лейкопении препарат временно отменяют (на 2–3 дня). Кроме того, при тяжелой форме часто добавляют преднизолон по 40–60 мг через день (альтернирующая схема) для купирования аутоиммунного процесса.
Стратегия лечения диффузного токсического зоба тиреостатиками неодинакова в разных странах, но при правильных показаниях длительное (около 1,5–2 лет) консервативное лечение при использовании стартовых высоких доз (Leclere L.) с последующим режимом «блокада-замещение», т. е. подключением малых доз L-тироксина при достижении эутиреоза, позволяет добиться длительной ремиссии более чем у 60 % больных.
Если болезнь развивается в течение I триместра беременности, рекомендуется использовать пропилурацил в минимально эффективных дозах (300 мг/сут в качестве стартовой и 50–150 мг/сут – в качестве поддерживающей дозы). Поскольку Пропицил не содержится в грудном молоке, грудное вскармливание не противопоказано.
Основанием для оперативного лечения служат большие размеры зоба (объем железы 30 мл и более), тяжелые формы диффузного токсического зоба, непереносимость тиреостатических препаратов, отсутствие стойкого эффекта от их применения, стойкая лейкопения.
В качестве предоперационной подготовки используются тиреостатические препараты и β-блокаторы (пропранолол, метопролол, атенолол). При их непереносимости, а также для ускорения достижения эутиреоза и в комплексном лечении эндокринной офтальмопатии применяют плазмаферез. В среднем эутиреоидное состояние наступает через 3–6 недель.
Использование раствора йодида калия (по 5 капель в день) в качестве предоперационной подготовки предложил еще Плюммер на основании эмпирического наблюдения, свидетельствовавшего об уменьшении васкуляризации железы и, следовательно, об облегчении проведения хирургического вмешательства под влиянием этого лечения. Сейчас необходимость использования йодида калия подвергается сомнению, однако 40 % хирургов в Европе пользуются этим методом.
Ранее некоторые авторы отрицали необходимость применения β-блокаторов перед операцией, считая, что их влияние на сердечно-сосудистую систему может маскировать недостаточную компенсацию тиреотоксикоза. Теперь известно, что эти препараты влияют на активность 5-дейодиназы и активируют превращение Т4 в биологически неактивный «реверсивный» Т3.
Для уменьшения зобогенного эффекта и васкуляризации железы предложено включать в предоперационную подготовку небольшие дозы тиреоидных гормонов. У больных с признаками эндокринной офтальмопатии рекомендуют использовать преднизолон в комплексе с радиоактивным йодом.
Использование радиоактивного йода в нашей стране ограничено возрастом больных (старше 45 лет), чаще метод используется при рецидиве тяжелого токсического зоба. В то же время в США применение 131-го йода рассматривают как оптимальный метод лечения больных старше 24 лет.
При тяжелом диффузном токсическом зобе и отсутствии выраженных повреждений миокарда йод вводят одномоментно в дозе 80–120 мкК на 1 г массы железы. Лишь при больших размерах железы и сопутствующей кардиальной патологии рекомендуется достижение эутиреоза до начала лечения 131-м йодом, затем лечение прекращают на 5–7 дней, вновь определяют захват йода щитовидной железой и проводят сканирование, а доза йода повышается до 120–150 мкК/г.
После лечения 131-м йодом гипотиреоз наблюдается в 80 % случаев, после операции – в 40 %, после лечения тиреостатиками – в 3–5 %.
Тиреотоксический криз
Показано, что средний уровень гормонов при кризе не отличается от такового вне криза. Важно, что при кризе уменьшается связывание тиреоидных гормонов и увеличивается количество свободных форм Т3 и Т4. Можно предположить, что для каждого больного существует индивидуальный уровень гормонов, нарушающий их равновесие, а также рецепторов к ним и рецепторов к катехоламинам. По мнению других авторов, в основе криза – увеличение аффинности к катехоламинам под влиянием триггерного механизма (инфекция, хиругический стресс, острое заболевание).
Первым этапом выведения больного из тиреотоксического криза должно стать применение глюкокортикоидов (ориентировочно по 50 мг гидрокортизона гемисукцината через каждые 4 ч, начальная доза – 100 мг внутривенно капельно в течение 30 мин).
Обязательно использование тиреостатических препаратов, предпочтение отдается пропицилу, который не только тормозит биосинтез тиреоидных гормонов, но и препятствует конверсии Т3 и Т4.
Введение β-блокаторов оправдано с позиций повышенной аффинности β-рецепторов, однако описаны случаи отека легких вследствие их отрицательного инотропного действия.
Пропранолол (Индерал, Анаприлин) вводится по 1–2 мг внутривенно медленно или по 40–60 мг внутрь через каждые 6 ч.
В качестве седативного препарата рекомендуется фенобарбитал, который ускоряет метаболизм и инактивацию Т4 путем его связывания с тироксинсвязывающим глобулином.
Непрерывно проводится дезинтоксикационная терапия, суммарное количество переливаемой жидкости (0,9 % р-р хлорида натрия, 5 % р-р глюкозы) может достигать около 3 л/сут. Введение неорганического йода одни авторы рекомендуют, другие признают бесполезным.
Эндокринная офтальмопатия при диффузном токсическом зобе
Лечение эндокринной офтальмопатии базируется на достижении эутиреоза (развитие гипофункции железы нежелательно). Некоторые авторы считают необходимым экстирпацию железы или ее деструкцию с помощью больших доз радиоактивного йода с последующей пожизненной заместительной терапией L-тироксином. Рекомендуется возвышенное положение головы для уменьшения периорбитальных отеков. Используют глюкокортикоиды в дозах 40–60 мг/сут. При неэффективности применяют облучение орбиты (обычно 2000 рад дробно в течение 2 нед). При угрозе зрению используется декомпрессия орбиты, удаление дна и латеральной стенки, что позволяет уменьшить экзофтальм на 5–7 мм. Мышечный фиброз иногда приводит к контрактуре век и двоению, что может быть устранено косметическими операциями. Больные ДТЗ нуждаются в пожизненном наблюдении у эндокринолога.


