ИЗОСЕРОЛОГИЧЕСКАЯ НЕСОВМЕСТИМОСТЬ КРОВИ МАТЕРИ И ПЛОДА. ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ ПЛОДА И НОВОРОЖДЁННОГО
Изосерологическая несовместимость крови матери и плода — несовместимость крови матери и плода по системе резус или АВ0.
Гемолитическая болезнь плода/новорождённого (ГБП/ГБН) — заболевание, характеризующееся гемолизом эритроцитов и/или угнетением гемопоэза под влиянием АТ, образующихся у матери к Аг эритроцитов плода, взаимно проникающих через плацентарный барьер, проявляющееся анемией, увеличением числа бластных форм эритроцитов, часто билирубина в крови плода/новорождённого.
СИНОНИМЫ
Эритробластоз плода, гемолитическая желтуха новорождённого.
Резус-сенсибилизация, резус-конфликт, изоиммунизация, аллоиммунизация, групповая несовместимость.
КОД ПО МКБ-10
Класс XV Беременность, роды и послеродовый период (O00–О99)
Медицинская помощь матери в связи с состоянием плода, амниотической полости и возможными трудностями
родоразрешения (О30–О48).
O36 Медицинская помощь матери при других установленных или предполагаемых патологических состояниях плода.
О36.0 Резус-иммунизация, требующая предоставления медицинской помощи матери.
О36.1 Другие формы иммунизации, требующие предоставления медицинской помощи матери.
Класс XVI Отдельные состояния, возникающие в перинатальном периоде (P00–P96)
Геморрагические и гематологические нарушения у плода и новорождённого (P50–P61).
P55 Гемолитическая болезнь плода и новорождённого.
Р55.0 Резус-изоиммунизация плода и новорождённого.
Р55.1 АВ0-изоиммунизация плода и новорождённого.
Р55.8 Другие формы гемолитической болезни плода и новорождённого.
Р55.9 Гемолитическая болезнь плода и новорождённого неуточнённая.
P56 Водянка плода, обусловленная гемолитической болезнью.
Р56.0 Водянка плода, обусловленная изоимунизацией.
Р56.9 Водянка плода, обусловленная другой неуточнённой гемолитической болезнью.
P57 Ядерная желтуха.
Р57.0 Ядерная желтуха, обусловленная изоиммунизацией.
P58 Неонатальная желтуха, обусловленная чрезмерным гемолизом.
ЭПИДЕМИОЛОГИЯ
ГБН, обусловленная несовместимостью крови матери и плода по системе АВ0, развивается в 10–20% случаев, при этом в 40 раз чаще у женщин с группой крови 0. Тяжёлые формы заболевания наблюдают в единичных случаях (1:3000 родов). Резус-сенсибилизация возможна при беременности, возникшей у супружеской пары, в которой мать имеет резус-отрицательную кровь, а отец — резус-положительную. Частота встречаемости резус-отрицательной принадлежности крови зависит от этнической принадлежности. Наиболее часто она выявляется у испанских басков — 30–32%, почти отсутствует у африканцев, у европейцев наблюдается у 15–16% населения.
ЭТИОЛОГИЯ (ПРИЧИНЫ) ГЕМОЛИТИЧЕСКОЙ БОЛЕЗНИ ПЛОДА И НОВОРОЖДЕННОГО
При резус-несовместимости кровь матери — резус-отрицательная, а у плода — резус-положительная. Выявление у женщин с резус-отрицательной кровью антирезус-АТ указывает на сенсибилизацию к Аг системы резус.
Изоиммунизация может также развиться и в результате несовместимости крови матери и плода по другим системам эритроцитарных Аг, например, системе АВ0, когда у матери 0 (I) группа крови, а у плода любая другая. Аг А и В плода могут проникать во время беременности в кровоток матери, приводя к выработке иммунных α- и β-АТ соответственно и развитию у плода реакции «Аг-АТ» (Аα, Вβ). Групповая несовместимость крови матери и плода, хотя и встречается чаще, чем несовместимость по другим системам Аг, но ГБП и ГБН при этом протекают легче и, как правило, не требуют интенсивной терапии.
Наибольшее клиническое значение имеет изосерологическая несовместимость по системе Аг Резус, так как 95% всех выраженных форм ГБП обусловлены несовместимостью по Аг D системы Резус (Rh) и только 5% — по другим системам эритроцитов. ГБП/ГБН может быть обусловлена несовместимостью по нескольким Аг одной или разных эритроцитарных систем.
Система Резус — система аллогенных эритроцитарных Аг человека, дифференциация которого начинается в ранние сроки внутриутробного развития (с 6–8-й недели беременности). Впервые белковый фактор в эритроцитах, обладающий антигенными свойствами, был обнаружен американскими учёными К. Ландштейнером и А. Винером в 1940 году. Ими в эксперименте показано, что эритроциты обезьян (макака-резус), введённые кроликам, вызывали у последних выработку АТ.
В настоящее время выделяют 6 основных Аг системы Rh (Dd, Cc, Ee). Каждый генный комплекс состоит из трёх антигенных детерминант: D или отсутствие D, С или с, Е или е в различных комбинациях. Существование Аг d до настоящего времени не подтверждено, так как не имеется гена, отвечающего за синтез указанного Аг. Несмотря на это, символ d применяется в иммуногематологии для обозначения факта отсутствия Аг D на эритроцитах при описании фенотипов.
Другими изосерологическими системами крови, с которыми может быть связан иммунологический конфликт, являются системы Келл–Челлано, Даффи, Кидд, MNSs, Лютеран и др. (табл. 38-1).
Таблица 38-1. Распределение антигенов эритроцитов по иммунологическому риску образовывать агрессивные антиэритроцитарные антитела
| Высокий | Низкий | Очень низкий | Отсутствует |
| D (система Резус) | e (система Резус) | S (система MNSs) | Lea (система Льюис) |
| K (система Келл) | Ce (система Резус) | U (система Келл) | Leb (система Льюис) |
| C (система Резус) | Kpa (система Келл) | M (система MNSs) | P (система Р) |
| E (система Резус) | Kpb (система Келл) | Fyb (система Даффи) | |
| C (система Резус) | CE (система Резус) | N (система MNSs) | |
| Fya (система Даффи) | k (система Келл) | Doa (система Домброк) | |
| s (система MNSs) | Coa (система Колтон) | ||
| Dia (система Диего) | |||
| Dib (система Диего) | |||
| Lu a (система Лютеран) | |||
| Yta (система Картрайт) | |||
| Jka (система Кидд) |
Наибольшее практическое значение имеет Аг Rh0(D) — основной Аг системы Резус. Он содержится на эритроцитах 85% людей, проживающих в Европе. Именно на основании наличия на эритроцитах Аг Rh0(D) выделяют резус- положительный тип крови. Кровь людей, эритроциты которых лишены этого Аг, относят к резус-отрицательному типу.
Люди с резус-положительной кровью могут быть гомозиготными (DD) и гетерозиготными (Dd). Если отец гомозиготен (DD), что отмечается у 40–45% всех мужчин с резус-положительной кровью, то доминантный ген D всегда передаётся плоду. Следовательно, у женщины с резус-отрицательной кровью (dd) плод будет Rh-положительным в 100% случаев.
Если отец гетерозиготен (Dd), что наблюдается у 55–60% всех резус-положительных мужчин, то плод будет резус- положительным в 50% случаев, так как возможно наследование и доминантного, и рецессивного гена. Определение гетерозиготности отца представляет определённые трудности и не может быть внедрено в рутинную практику.
Поэтому беременность у женщины с резус-отрицательной кровью от мужчины с резус-положительной кровью следует вести как беременность плодом с резус-положительной кровью.
ПАТОГЕНЕЗ
Иммунизация женщин с резус-отрицательной кровью происходит при беременности плодом с резус-положительной кровью в результате плодово-материнской трансфузии. Возможна также ятрогенная изоиммунизация вследствие введения в организм резус-отрицательной женщины резус-положительной крови (гемотрансфузия).
При физиологической беременности эритроциты плода проникают через плаценту у 3% женщин в первом, у 15% — во втором, у 45% — в третьем триместрах беременности. Объём фетальной крови в кровотоке матери возрастает с увеличением срока беременности и достигает около 30–40 мл в родах. Поэтому сенсибилизация может наступать после искусственного и самопроизвольного аборта, внематочной беременности. Наиболее часто трансплацентарная трансфузия наблюдается во время родов, особенно при оперативных вмешательствах (ручное отделение плаценты, КС). В процессе беременности резус-иммунизации способствует нарушение целостности ворсин хориона, вследствие чего происходит попадание эритроцитов плода в кровоток матери (гестоз, угроза прерывания беременности, преждевременная отслойка плаценты, экстрагенитальная патология, проведение инвазивных процедур – биопсии хориона, амниоцентеза, кордоцентеза). Степень риска резус-иммунизации при оценке различных анамнестических факторов представлена в табл. 38-2.
Таблица 38-2. Степень риска резус-иммунизации
| Факторы риска иммунизации | Риск иммунизации, % |
| Самопроизвольный аборт | 3–4 |
| Искусственный аборт | 2–5 |
| Внематочная беременность | <1 |
| Доношенная беременность (до родоразрешения) | 1–2 |
| Роды при совместимости по АВ0-системе | 16 |
| Роды при АВ0-несовместимости | 2–3,5 |
| Инвазивные процедуры | 1–3 |
| Переливание резус-положительной крови | 90–95 |
Первичным ответом матери на попадание в кровоток резус-Аг является выработка I- M («полные» АТ), которые имеют крупную молекулярную массу, не проникают через плацентарный барьер и поэтому не имеют значения в развитии ГБП. При повторном попадании резус-Аг в сенсибилизированный организм матери происходит быстрая и массивная продукция I- - («неполные» АТ), которые вследствие низкой молекулярной массы легко проникают через плаценту и являются причиной развития ГБП. I- - состоят из 4-х субклассов, значительно отличающихся по своей агрессивности к эритроцитам. Агрессивными являются I- - первого и третьего субклассов.
Выработанные АТ, проникая из кровотока беременной к плоду, вступают в реакцию с Аг эритроцитов плода (реакция «Аг-АТ»). При этом происходит их гемолиз с образованием непрямого токсичного билирубина. Разрушение эритроцитов является основной причиной развивающейся у плода анемии, а накопление непрямого билирубина приводит к развитию желтухи.
В результате развившейся гемолитической анемии стимулируется синтез эритропоэтина. Когда образование в костном мозге эритроцитов не может компенсировать их разрушение, возникает экстрамедуллярное кроветворение в печени, селезёнке, надпочечниках, почках, плаценте и слизистой оболочке кишечника плода. Это приводит к обструкции портальной и пуповинной вен, портальной гипертензии, нарушению белковосинтезирующей функции печени — гипопротеинемии. Снижается коллоидно-осмотическое давление крови, результатом чего являются асцит, генерализованные отёки у плода. Компенсаторно увеличивается сердечный выброс и минутный объём, формируется гипердинамический тип кровообращения. Наблюдается гипертрофия миокарда, в дальнейшем — СН. Тяжесть состояния плода обусловлена также прогрессирующей тканевой гипоксией, нарастанием ацидоза.
Поскольку непрямой билирубин хорошо растворяется в липидах, он в первую очередь поражает ядра клеток головного мозга, что в периоде новорождённости способствует развитию билирубиновой энцефалопатии и ядерной желтухи.
Таким образом, анемия и высокий уровень билирубина являются основными наиболее часто встречающимися симптомами ГБП, при тяжёлых формах заболевания возможно развитие водянки у плода вплоть до анасарки.
Редкая встречаемость тяжёлых форм ГБП и ГБН при АВ0 несовместимости объясняется рядом факторов: связыванием большого количества анти-А и анти-В АТ с Аг А и Аг В, растворёнными в тканях плаценты, плазме крови, ОВ; структурой Аг А и Аг В фетальных эритроцитов, позволяющей связывать только небольшое количество АТ, даже если их много; преимущественным наличием анти-А и анти-В АТ в виде I- - 2.
Существует и другой патогенетический вариант развития заболевания, при котором анемия, развивающаяся у плода/новорождённого имеет не гемолитический, а апластический характер. Этот вариант развивается при несовместимости крови матери и плода по Аг К (система Келл). Анти-К АТ вызывают не гемолиз эритроцитов, а угнетение гемопоэза у плода, поэтому в его крови и АЖ будут отсутствовать повышенные уровни билирубина, в клинической картине заболевания у новорождённого не наблюдается желтухи.
КЛИНИЧЕСКАЯ КАРТИНА (СИМПТОМЫ) НЕСОВМЕСТИМОСТИ КРОВИ МАТЕРИ И ПЛОДА
Специфическая клиническая картина заболевания у беременных отсутствует, хотя некоторые авторы описывают так называемый «зеркальный синдром», при котором параллельно с нарастанием проявлений «внутриутробной катастрофы» у матери наблюдается комплекс симптомов, в целом напоминающий гестоз.
Заболевание диагностируют на основании данных лабораторного и инструментального исследования.
ДИАГНОСТИКА
ДИАГНОСТИКА РЕЗУССЕНСИБИЛИЗАЦИИ
Диагностика резус-сенсибилизации у матери основывается на результатах изучения анамнеза, определения наличия/отсутствия титра эритроцитарных АТ в её периферической крови. Диагностика ГБП основана на данных ультразвуковой фето-, плацентометрии, исследования количества ОВ, ультразвуковых признаках наличия отёка у плода, допплерометрического исследования мозгового кровотока плода с целью выявления анемии, оценки функционального состояния плода. При получении неинвазивных данных о наличии анемии проводится амнио- и кордоцентез с последующей гемотрансфузией.
Наличие в анамнезе женщины с резус-отрицательной кровью гемотрансфузии без учёта резус-принадлежности её крови, самопроизвольного прерывания беременности, антенатальной смерти плода в предыдущих беременностях или рождения ребёнка с ГБН являются прогностически неблагоприятными и указывают на повышенный риск заболевания плода при данной беременности.
У пациенток с резус-отрицательной кровью необходимо с ранних сроков (6–12 нед) или при первом обращении исследовать кровь на наличие антиэритроцитарных АТ и определять их титр в динамике (1 раз в месяц на протяжении всей беременности).
Титр АТ соответствует наибольшему разведению сыворотки, при котором в ней ещё возможна реакция агглютинации «Аг-АТ» (титр АТ может быть равен 1:2, 1:4, 1:8, 1:16 и т.д.). Абсолютная величина титра АТ в крови матери при определении степени тяжести заболевания плода не имеет решающего значения для прогноза развития заболевания у плода/новорождённого (возможно рождение детей с резус-отрицательной кровью у резус-сенсибилизированных женщин). Титр АТ в течение беременности может нарастать, оставаться без изменений, снижаться, а иногда наблюдается скачкообразное изменение титра (чередующиеся повышение и понижение), что имеет относительное значение.
ДИАГНОСТИКА ГЕМОЛИТИЧЕСКОЙ БОЛЕЗНИ ПЛОДА
Большое значение в диагностике ГБП имеет УЗИ с фето- и плацентометрией. Для определения первых признаков ГБП УЗИ целесообразно производить, начиная с 18–20 нед. До этого срока ультразвуковые признаки ГБП, как правило, не выявляются. В дальнейшем УЗИ проводят по показаниям, в зависимости от динамики ультразвуковых и допплерометрических данных. При благоприятных результатах у сенсибилизированных больных желательно проводить исследования в динамике не реже одного раза в 2–3 нед, при тяжёлых формах ГБП УЗИ иногда проводят каждые 1–3 дня.
Одним из ультразвуковых признаков ГБП является увеличение толщины плаценты — превышение нормальной для срока беременности толщины плаценты на 0,5–1,0 см. На наличие ГБП указывают также увеличение размеров печени, селезёнки плода (органы экстрамедуллярного кровообращения), многоводие. Дополнительным ультразвуковым критерием заболевания может служить расширенная вена пуповины (более 10 мм).
Наиболее точно при УЗИ ставится диагноз отёчной формы ГБП, критериями которой являются выраженная плацентомегалия (до 6,0–8,0 см), гепатоспленомегалия, асцит, многоводие (рис. 38-1). К патологическим ультразвуковым признакам при выраженной водянке плода относятся также кардиомегалия и перикардиальный выпот, гидроторакс, повышенная эхогенность кишечника вследствие отёка его стенки, отёк подкожной клетчатки головы, туловища и конечностей плода.
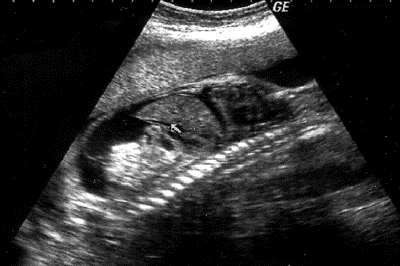
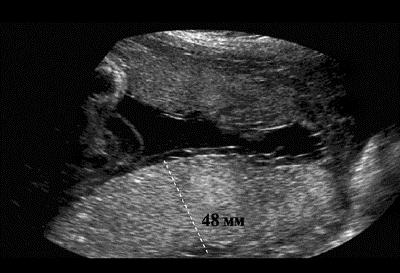
Рис. 38-1. Отёчная форма гемолитической болезни плода, эхограмма (а – плацентомегалия, б – асцит).
В настоящее время ведущее место в диагностике анемии у плода занимает допплерометрическое исследование максимальной скорости кровотока в средней мозговой артерии. Увеличение максимальной скорости кровотока, выраженной в МоМ, более 1,5 для срока беременности с высокой чувствительностью и специфичностью свидетельствует о развитии у плода гипердинамического типа кровообращения, характерного для тяжёлой анемии (рис. 38-2). При получении таких данных проводят инвазивную уточняющую диагностику — амнио- и кордоцентез.
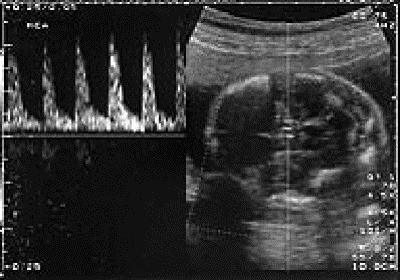
Рис. 38-2. Кровоток в средней мозговой артерии при гемолитической болезни плода, допплерограмма.
Учитывая, что гипербилирубинемия является одним из основных признаков ГБП, для диагностики заболевания возможно определять оптическую плотность ОВ, повышающуюся по мере увеличения концентрации в них билирубина (оптической плотности) за счёт выделения почками плода. Величину оптической плотности билирубина в ОВ можно определять, используя фотоэлектроколориметр или, предпочтительнее, спектрофотометр с длиной волны 450 нм. В 34–35 нед уровень оптической плотности билирубина менее 0,1 отн.ед. свидетельствует об отсутствии заболевания плода. Повышение оптической плотности билирубина происходит при развитии ГБП: значения 0,1–0,15 указывают на лёгкую степень заболевания, 0,15–0,2 — среднюю; оптическая плотность билирубина более 0,2 с большой вероятностью позволяет предположить наличие тяжёлой формы ГБП. Более точно и в более ранние сроки беременности (начиная с 24 нед) оценить тяжесть ГБП возможно при исследовании оптической плотности билирубина в АЖ при различных длинах волн света (от 300 до 700 нм) с помощью спектрофотометра. Полученные значения оптической плотности билирубина интерпретируют согласно шкале Лили, которая делится на зоны: 1, 2А, 2В, 2С, 3 (рис. 38-3).
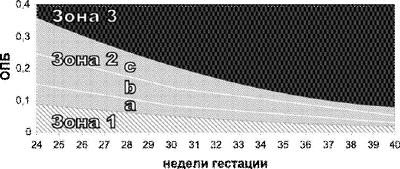
Рис. 38-3. Шкала Лили.
Если значение оптической плотности билирубина соответствует первой зоне, плод следует считать здоровым или резус-отрицательным. Если значение оптической плотности билирубина соответствует третьей зоне шкалы Лили, то при сроке гестации до 34 нед показано проведение кордоцентеза и внутриутробного переливания крови, после 34-й недели следует провести родоразрешение.
Долгое время метод Лили считали одним из основных для диагностики степени тяжести ГБП. Однако в настоящий момент этот метод представляет исторический интерес, имеет относительное значение, поскольку он неинформативен при апластическом характере анемии у плода, промежуточные его значения (2-я зона) не дают чётких представлений о тяжести заболевания и требуют выполнения повторных инвазивных вмешательств, усиливающих сенсибилизацию. Поэтому его используют только в качестве дополнительного метода при диагностических кордоцентезах.
Наиболее точным методом выявления ГБП и степени её тяжести является исследование плодовой крови, полученной путем кордоцентеза (пункции пуповины). Кордоцентез проводят с 18 нед беременности. Единственным показанием к нему являются данные допплерометрии, свидетельствующие о наличии у плода анемии, поскольку только тяжёлая анемия является показанием к внутриутробному лечению. Другие показания к выполнению инвазивных вмешательств у сенсибилизированных пациенток отсутствуют, поскольку все они усиливают сенсибилизацию.
При проведении кордоцентеза кровь плода исследуют на группу и резус-принадлежность, уровни Hb и Ht, можно выполнить непрямую пробу Кумбса и определение билирубина.
Нормативные показатели Hb и Ht у плода в различные сроки гестации представлены в табл. 38-3.
Таблица 38-3. Показатели гемоглобина и гематокрита у здоровых плодов
| Срок беременности, нед | 24–25 | 26–29 | 30–33 | 34 |
| Hb (г/л) | 113±17 | 125±9 | 129±12 | 144±13 |
| Ht (%) | 35±3 | 38±3 | 39±3 | 44±5 |
Анемию у плода считают легкой при 0,65 < Hb < 0,84 МоМ, средней — при 0,55 < Hb <0,65 МоМ, тяжёлой — при Hb < 0,55 МоМ для срока беременности. Противопоказаниями к проведению кордоцентеза является выраженная угроза прерывания беременности.
При проведении кордоцентеза возможны следующие осложнения: кровотечение из места пункции пуповины; гематома пуповины; плодово-материнские кровотечения; отслойка плаценты; острая гипоксия плода; преждевременное излитие вод; преждевременные роды; инфицирование. Антенатальные потери наблюдаются в 0,5–2% наблюдений.
В последние годы разработан и начинает использоваться в практике метод, позволяющий исследовать фетальные эритроциты в периферической крови матери с целью диагностики резус-принадлежности крови плода. Установленная в ранние сроки беременности резус-отрицательная принадлежность крови плода (точность диагностики до 100%) позволяет избежать необоснованных инвазивных диагностических вмешательств.
Учитывая, что ГБП нередко сопровождается его гипоксией, необходимо оценить его функциональное состояние при КТГ. Интерпретацию кардиотокограмм производят согласно шкале оценки сердечной деятельности плода.
Регистрация при КТГ кривой «синусоидального» типа свидетельствует о наличии тяжёлой формы ГБП. При признаках нарушения функционального состояния плода мониторинг необходимо проводить ежедневно.
В большинстве случаев ультразвуковая фето- и плацентометрия, оценка скорости кровотока в средней мозговой артерии плода, результаты амниоцентеза и кордоцентеза позволяют выработать правильную тактику ведения пациентки. План ведения зависит от срока беременности, состояния плода и уровня перинатальной службы в данном учреждении (возможность проведения внутриматочных гемотрансфузий и выхаживания недоношенных детей).
ДИАГНОСТИКА ГЕМОЛИТИЧЕСКОЙ БОЛЕЗНИ НОВОРОЖДЁННОГО
Сразу после рождения ребёнка у женщин с резус-отрицательной кровью или резус-сенсибилизацией необходимо произвести определение резус-принадлежности и группы крови новорождённого, содержания Hb и билирубина в крови, взятой из пуповины.
В раннем неонатальном периоде выделяют три основные клинические формы ГБН:
• гемолитическая анемия без желтухи и водянки;
• гемолитическая анемия с желтухой;
• гемолитическая анемия с желтухой и водянкой.
Гемолитическая анемия без желтухи и водянки — наиболее лёгкая форма заболевания. У детей при рождении отмечается бледность кожных покровов, в крови снижен уровень Hb (менее 140 г/л). Желтуха отсутствует или проявляется на 2–3-и сут, выражена незначительно и исчезает к 7–10-му дню.
Гемолитическая анемия с желтухой встречается наиболее часто и характеризуется желтушным окрашиванием кожных покровов и слизистых оболочек при рождении или вскоре после рождения (в отличие от физиологической желтухи, которая проявляется на 2–3 сутки). Отмечается увеличение печени и селезёнки; наряду со снижением Hb в периферической крови новорождённого наблюдается гипербилирубинемия.
Без проведения лечебных мероприятий в ближайшие 2–3 дня интенсивность желтухи нарастает, общее состояние ухудшается, появляются симптомы билирубиновой интоксикации (вялость, снижение врождённых безусловных рефлексов, приступы апноэ). Возможно развитие билирубиновой энцефалопатии (ядерной желтухи): беспокойство, усиление тонуса разгибательной мускулатуры, тонические судороги, симптом «заходящего солнца».
Гемолитическая анемия с желтухой и водянкой является наиболее тяжёлым проявлением заболевания, нередко заканчивающейся внутриутробной гибелью плода или смертью новорождённого. При этой форме наблюдаются выраженная анемия и тромбоцитопения, генерализованные отёки, скопление жидкости в серозных полостях (асцит, гидроперикард, гидроторакс) и геморрагический синдром. Печень, селезёнка резко увеличены и уплотнены вследствие наличия очагов экстрамедуллярного кроветворения. ГБН классифицируется также по степени тяжести в зависимости от выраженности гемолиза (табл. 38-4).
Таблица 38-4. Критерии степени тяжести гемолитической болезни новорождённых
| Клинические признаки | Степень тяжести ГБН | ||
| лёгкая | средняя | тяжелая | |
| Анемия (Hb в пуповинной крови) | >150 г/л(>15 г%) | 149–100 г/л(15,1–10,0 г%) | < 100 г/л(<10 г%) |
| Желтуха (билирубин в пуповинной крови) | <85,5 мкмоль/л(<5,0 мг%) | 85,6–136,8 мкмоль/л(5,1–8,0 мг%) | >136,9 мкмоль/л(>8,0 мг%) |
| Отёчный синдром | Пастозность подкожной клетчатки | Пастозность и асцит | Универсальный отёк |
ЛЕЧЕНИЕ НЕСОВМЕСТИМОСТИ КРОВИ МАТЕРИ И ПЛОДА
Лечение изосерологической несовместимости крови матери и плода не проводят. К настоящему времени признаны неэффективными методы, «снижающие» степень сенсибилизации (уровень титра АТ): неспецифическая десенсибилизирующая терапия, трансплантация кожного лоскута от мужа, гемосорбция, плазмоферез.
Лечение ГБП состоит во внутрисосудистой гемотрансфузии плоду при среднетяжёлой и тёжелой анемии.
Внутриутробное переливание крови повышает уровень Hb и Ht, снижает риск развития отёчной формы ГБП и позволяет пролонгировать беременность. Кроме того, переливание плоду отмытых эритроцитов способствует ослаблению иммунного ответа организма беременной за счёт снижения относительного количества резус- положительных эритроцитов и поддержанию Ht плода на уровне выше критического.
Для внутрисосудистой гемотрансфузии проводят кордоцентез и осуществляют забор крови плода для определения предтрансфузионного Ht плода. После получения пробы плодовой крови рассчитывают необходимый объем трансфузии с учётом уровней Ht плода, донорской крови и срока беременности. Для внутриутробного переливания крови используют эритроцитную массу (отмытые эритроциты 0(I) группы резус-отрицательной крови), скорость введения не должна превышать 1–2 мл/мин. С целью оптимизации условий проведения трансфузии возможно проведение миорелаксации плода введением раствора ардуана; для борьбы с отёчным синдромом гемотрансфузию сочетают с переливанием 20% раствора альбумина.
По окончании гемотрансфузии производят контрольный забор крови плода для определения посттрансфузионного Ht и Hb с целью оценки эффективности процедуры.
Необходимость повторных гемотрансфузий определяется сроком беременности. При решении вопроса о сроках проведения повторных гемотрансфузий учитывают показатели максимальной систолической скорости кровотока в средней мозговой артерии плода.
Внутриутробные переливания крови могут проводиться неоднократно до 32–34 нед беременности, после этого гестационного возраста решают вопрос о досрочном родоразрешении.
Лечение ГБН. Лёгкая форма ГБН требует ежедневного контроля уровня Hb, Ht и билирубина. По показаниям проводят коррекцию анемии резус-отрицательной эритроцитарной массой, соответствующей группе крови новорождённого. Эритроцитную массу следует переливать через катетер, введённый в центральную или периферическую вену, с помощью шприцевого насоса со скоростью 10–12 мл/ч, желательно под контролем АД, ЧСС и диуреза.
Показана также инфузионная терапия, направленная на дезинтоксикацию организма новорождённого, повышение билирубиносвязывающей способности альбумина крови и коррекцию метаболических нарушений. В состав инфузионных сред включаются следующие растворы: 10% раствор глюкозы, 5% раствор альбумина по 8–10 мл/кг, плазма по 10–15 мл/кг. Общий объём вводимой жидкости должен составлять 100–150% физиологической потребности новорождённого.
Параллельно проводят фототерапию, которая направлена на разрушение в коже новорождённого непрямого билирубина до его водорастворимых дериватов. Для светолечения используют лампы дневного или синего света с длиной волны 460–480 нм. Фототерапию проводят в кювезе в непрерывном или импульсном режиме.
Лечение детей с ГБН средней тяжести, помимо вышеуказанных инфузионной терапии и фототерапии включает также внутрижелудочное капельное (со скоростью 10–12 мл/ч) введение жидкости в целях предотвращения холестаза и абсорбции билирубина, экскретируемого в кишечник. Общий объём жидкости должен составлять 60–70 мл/кг массы тела (плазма 10–15 мл/кг, раствор 25% магния сульфата 5–8 мл/кг, 4% раствор хлористого калия 5–8 мл/кг, 5% раствор глюкозы).
Основным методом лечения гипербилирубинемии у новорождённого является заменное переливание крови.
Заменное переливание крови делят на раннее (в 1–2-е сут жизни) и позднее (с 3-х суток жизни). Раннее заменное переливание крови проводят с целью выведения из кровотока новорождённого билирубина и заблокированных АТ эритроцитов, повышения уровня Hb. Целью позднего заменного переливания крови является, в основном, предупреждение билирубиновой интоксикации.
Показания к раннему заменному переливанию крови:
• содержание общего билирубина в пуповинной крови более 100 мкмоль/л;
• почасовой прирост билирубина более 10 мкмоль/л для доношенного ребёнка, почасовой прирост 8 мкмоль/л для недоношенного ребёнка.
Показания к позднему заменному переливанию крови:
• содержание общего билирубина более 308–340 мкмоль/л у доношенного ребенка и более 272–290 мкмоль/л у недоношенного ребёнка массой тела более 2 кг.
При ГБН, вызванной резус-конфликтом, для заменного переливания крови используют одногруппную резус- отрицательную кровь или смесь резус-отрицательной эритроцитарной массы и одногруппной с ребёнком плазмы. При несовместимости по групповым факторам необходимо переливание эритроцитной массы 0(I) группы (соответственно резус-принадлежности ребёнка) и одногруппной плазмы.
Прикладывание к груди проводят после уменьшения желтухи и снижения билирубина при общем удовлетворительном состоянии ребёнка, как правило, с 5–6-го дня жизни. АТ, содержащиеся в молоке, не проникают через кишечную стенку в силу своей крупнодисперсности и не оказывают вредного влияния на уровень Hb.
При отёчной форме ГБН необходимо немедленное восполнение ОЦК и коррекция уровня Hb для борьбы с выраженной гипоксией и анемией. В связи с сердечно-сосудистой недостаточностью первое заменное переливание крови возможно провести «малым» объёмом из расчёта 60–70 мл/кг эритроцитарной массы.
При выраженной дыхательной недостаточности, обусловленной отёком лёгких, показано проведение ИВЛ до купирования лёгочной недостаточности. При выраженном асците лапароцентез проводят под контролем УЗИ. Для предупреждения гипотонии у новорождённого асцитическую жидкость следует выводить медленно. В связи с выраженной СН, обусловленной дистрофией миокарда, показаны терапия сердечными гликозидами по общепринятой методике, ранняя профилактика холестаза.
Проведение фототерапии при отёчной форме заболевания ограничено, так как в первые дни жизни у ребёнка наблюдается накопление большого количества прямого билирубина и возможно такое осложнение, как «синдром бронзового младенца».
ТАКТИКА ВЕДЕНИЯ РОДОВ
Способ родоразрешения беременных с резус-сенсибилизацией зависит от состояния плода, срока беременности, паритета и подготовленности родовых путей.
При отсутствии клинических признаков тяжёлой формы заболевания плода, сроке беременности, близком к доношенному (свыше 36 нед), и зрелой шейке матки роды ведут через естественные родовые пути. Если заболевание плода расценивают как тяжёлое, то предпочтительнее оперативное родоразрешение, так как КС позволяет избежать дополнительной травматизации больного плода во время родов.
ПРОФИЛАКТИКА РЕЗУССЕНСИБИЛИЗАЦИИ
Решение проблемы резус-сенсибилизации заключается в своевременном проведении профилактических мероприятий, которые включают:
• осуществление любого переливания крови с учётом резус-принадлежности крови пациентки и донора;
• сохранение первой беременности у женщин с резус-отрицательной кровью;
• специфическая профилактика у женщин с резус-отрицательной кровью без явлений сенсибилизации путем введения иммуноглобулина человека антирезус Rho[D] после любого прерывания беременности (роды резус-положительным плодом, аборты, внематочная беременность).
Для специфической профилактики резус-сенсибилизации используют иммуноглобулин человека антирезус Rho[D] (специфические АТ). Эффект иммуноглобулина человека антирезус Rho[D] обусловлен механизмом торможения иммунного ответа за счёт связывания имеющихся в организме матери Аг.
Препарат вводят по одной дозе (300 мкг) внутримышечно однократно: родильнице не позже, чем через 72 ч после родов (желательно в течение первых двух часов), после искусственного прерывания беременности и при внематочной беременности непосредственно по окончании операции. После КС, ручного отделения плаценты, а также при отслойке плаценты дозу препарата необходимо удвоить (600 мкг).
Очень важна также антенатальная профилактика резус-сенсибилизации всем беременным с резус-отрицательной кровью и отсутствием резус-АТ в сыворотке крови. Это обусловлено тем, что трансплацентарный переход эритроцитов плода в материнский кровоток происходит с 28 нед беременности, и начало сенсибилизации может происходить до родоразрешения. Поэтому в 28 нед гестации все неиммунизированные беременные с резус- отрицательной кровью при условии, что отец плода резус-положительный, должны получать профилактически 300 мкг иммуноглобулина человека антирезус Rho[D], который не проходит через плаценту и специально разработан для антенатальной профилактики резус-сенсибилизации. Антенатальную профилактику проводят также после инвазивных процедур (биопсия хориона, амниоцентез, кордоцентез) независимо от срока беременности.
Если в 28 нед проводилась профилактика иммуноглобулином человека антирезус Rho[D], то определение резус-АТ в крови беременной не имеет клинического значения!
При рождении ребёнка с резус-положительной кровью инъекцию иммуноглобулина человека антирезус Rho[D] осуществляют повторно после родов в течение первых 72 ч.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Женщины детородного возраста должны знать резус-принадлежность своей крови. Женщины с резус-отрицательной кровью должны быть информированы о целесообразности сохранения первой беременности, а также о необходимости профилактики резус-сенсибилизации путём введения антирезус-иммуноглобулина после абортов и внематочной беременности.
При планировании беременности женщине необходимо также знать резус-принадлежность и группу крови отца будущего ребёнка. Все неиммунизированные беременные с резус-отрицательной кровью должны быть осведомлены о необходимости профилактического введения иммуноглобулина человека антирезус Rho[D] после диагностических инвазивных процедур (биопсия хориона, амниоцентез, кордоцентез) в 28 нед беременности, а также после родов (не позже, чем через 72 ч).
Женщинам с резус-сенсибилизацией и чрезвычайно отягощённым анамнезом (гибель детей от ГБН) необходимо знать о возможности наступления беременности плодом с резус-отрицательной кровью с помощью ЭКО. При ЭКО в процессе преимплантационной диагностики отбираются и переносятся в матку именно те эмбрионы, которые наследуют материнскую резус-отрицательную кровь. При этом обязательным условием является гетерозиготность отца по резус-фактору (Dd), когда в 50% возможно ожидать, что плод будет с резус-отрицательной кровью.
ПРОГНОЗ
Зависит от тяжести заболевания плода и своевременности начатого лечения при ГБП и ГБН. Более благоприятный прогноз при ГБП и ГБН, обусловленной несовместимостью крови матери и плода по АВ0.

