ГИПЕРПЛАСТИЧЕСКИЕ ПРОЦЕССЫ ЭНДОМЕТРИЯ
К гиперпластическим процессам эндометрия (ГПЭ) относят различные варианты гиперплазии эндометрия и полипы эндометрия.
КОД ПО МКБ-10
N84.0 Полип тела матки.
N85.0 Железистая гиперплазия эндометрия.
N85.1 Аденоматозная гиперплазия эндометрия.
ЭПИДЕМИОЛОГИЯ ГПЭ
В последние годы отмечен рост заболеваемости ГПЭ, что связывают как с увеличением продолжительности жизни женщин, так и с увеличением числа женщин с нейроэндокринными расстройствами, сопровождающимися нарушениями обмена веществ, неблагоприятной экологической обстановкой, ростом числа хронических соматических заболеваний со снижением иммунитета.
Гиперплазию эндометрия отмечают примерно у 5% гинекологических больных. Данные о частоте атипической гиперплазии эндометрия касаются в основном женщин пери и постменопаузального возраста и варьируют в широких пределах от 2,1 до 10,1%.
Полипы эндометрия обнаруживают у 5,3–25% гинекологических больных всех возрастных групп, но наиболее часто в пре и постменопаузе.
ПРОФИЛАКТИКА ГПЭ
- Своевременная диагностика и лечение пациенток с различными нарушениями менструальной функции, начиная с менархе.
- Коррекция различных нейроэндокринных расстройств и нарушений обмена веществ.
- Здоровый образ жизни (избегать ИППП, внутриматочных вмешательств, искусственных прерываний беременности).
- Адекватное обследование и лечение ГПЭ при первом обнаружении.
СКРИНИНГ
- Ультразвуковое исследование трансвагинальным датчиком, в сомнительных случаях — гидросонография.
- Аспират из полости матки или биопсия эндометрия.
КЛАССИФИКАЦИЯ ГПЭ
В России наиболее распространена гистологическая классификация, разработанная экспертами ВОЗ в 1975 г. и модифицированная Б.И. Железновым в 1980 г. В соответствии с этой классификацией выделяют: железистые, железисто- фиброзные и фиброзные эндометриальные полипы; железистую, железистокистозную очаговую и диффузную гиперплазию эндометрия; атипическую гиперплазию эндометрия или аденоматоз (очаговый или диффузный), включая аденоматозные полипы.
К предраку эндометрия отечественные онкогинекологи относят атипическую гиперплазию эндометрия, которую подразделяют на лёгкую, среднюю и тяжёлую степени.
В 1994 г. ВОЗ приняла новую классификацию гиперплазии эндометрия, основанную на рекомендациях ведущих гинекологов, онкологов и патоморфологов. Согласно этой классификации, гиперплазию эндометрия разделяют на гиперплазию без атипии и гиперплазию с атипией.
- Гиперплазия эндометрия — пролиферация эндометриальных желёз без цитологической атипии.
♦Простая гиперплазия эндометрия соответствует железистокистозной гиперплазии с характерным для этого состояния избыточным ростом преимущественно эпителиального компонента желёз.
♦Комплексная, или сложная (аденоматоз), гиперплазия соответствует атипической гиперплазии I степени, отличается от простой гиперплазии эндометрия структурной перестройкой желёз и пролиферацией желёз эпителия. - Атипическая гиперплазия эндометрия — пролиферация эндометриальных желёз с признаками цитологической атипии.
♦Простая атипическая гиперплазия эндометрия соответствует атипической гиперплазии эндометрия II степени и отличается выраженной пролиферацией железистого эпителия при отсутствии в нём признаков клеточного и ядерного полиморфизма.
♦Комплексная, или сложная, атипическая гиперплазия эндометрия (аденоматоз с атипией) аналогична атипической гиперплазии эндометрия III степени выраженности и имеет признаки клеточного и ядерного полиморфизма наряду с дезорганизацией эпителия эндометриальных желёз. Приведённая классификация имеет значение для определения тактики ведения пациентки, так как чрезвычайно важно отличие атипической гиперплазии эндометрия от гиперплазии эндометрия — нарушение тканевой дифференцировки. Комплексная, или сложная, атипическая гиперплазия, в отличие от высокодифференцированной аденокарциномы, не имеет признаков стромальной инвазии. Многие клиницисты обоснованно продолжают использовать термин «предрак эндометрия». С морфологических позиций к предраку эндометрия относят: гиперплазию с атипией (атипическая гиперплазия) и аденоматозные полипы. Г.М. Савельева и В.Н. Серов в 1980 г. предложили клиникоморфологическую классификацию, согласно которой с позиций клиницистов условно к предраку эндометрия относят: - атипическую гиперплазию эндометрия и аденоматозные полипы в любом возрасте;
- рецидивирующую железистую гиперплазию эндометрия на фоне нейроэндокринных расстройств и нарушений обмена веществ в любом возрасте;
- железистую гиперплазию эндометрия в постменопаузе при первом выявлении. В зависимости от гистологического строения полипы эндометрия делят на железистые (функционального, базального типа), железистофиброзные и фиброзные. Аденоматозные полипы относят к предраковым состояниям слизистой матки.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ ГПЭ
По мнению большинства исследователей, к возникновению патологической трансформации эндометрия приводят гормональные нарушения, затрагивающие все звенья нейрогуморальной регуляции организма женщины.
Эндометрий — орган-мишень для половых гормонов из-за присутствия в нём специфических рецепторов.
Сбалансированное гормональное воздействие через цитоплазматические и ядерные рецепторы обеспечивает физиологические циклические превращения слизистой оболочки матки. Нарушение гормонального гомеостаза женщины может привести к изменению роста и дифференцировки клеточных элементов эндометрия и повлечь за собой развитие гиперпластических или неопластических процессов в эндометрии.
Ведущее место в патогенезе ГПЭ отводят гиперэстрогении (относительной или абсолютной), возникающей на фоне отсутствия или недостаточного антиэстрогенного влияния прогестерона. Причинами гиперэстрогении могут быть:
- патологические или возрастные изменения центральной регуляции репродуктивной функции, приводящие к НЛФ или ановуляции;
- гиперпластические процессы в яичниках или гормонопродуцирующие опухоли яичников (кистозноатрезирующие фолликулы, фолликулярные кисты с гиперплазией или лютеинизацией, стромальная гиперплазия, текоматоз, гранулезоклеточная опухоль, текаклеточные опухоли и др.);
- гиперплазия коры надпочечников;
- неправильное использование гормональных препаратов (эстрогены, антиэстрогены).
Обычно риск развития ГПЭ, а также и рака эндометрия связан не столько с ятрогенным влиянием экзогенных эстрогенов, сколько с эндогенной гиперэстрогенией. При этом абсолютная гиперэстрогения с избыточной секрецией эстрогенов имеет меньшее клиническое значение, поскольку её вызывают в основном нечасто встречающиеся эстрогенпродуцирующие феминизирующие опухоли яичников (гранулёзоклеточная, стромальноклеточная, текаклеточная опухоли), при которых ГПЭ встречаются в 46,7–93,5% случаев.
В развитии ГПЭ в большей степени играет роль не абсолютная, а относительная гиперэстрогения, проявляющаяся длительным воздействием эстрогенов на фоне дефицита прогестерона, обладающего антипролиферативным эффектом. В связи с этим нарушения функции яичников, сопровождающиеся хронической ановуляцией в репродуктивном возрасте и в перименопаузе, рассматривают как фактор риска ГПЭ. Известно, что у женщин с хронической ановуляцией повышен риск развития рака эндометрия в 3 раза.
Фактор риска пролиферативных изменений эндометрия — СПКЯ, при котором отмечают хроническую ановуляцию. С современных позиций СПКЯ характеризуется не только хронической ановуляцией, но и гиперандрогенией, сочетающейся с инсулинрезистентностью и гиперинсулинемией. Инсулин способен влиять на стероидогенез в яичниках, стимулируя в них продукцию андрогенов и эстрадиола, а также приводить к увеличению в крови свободных фракций половых стероидов, снижая уровень белка, связывающего их. Значение андрогенов в развитии пролиферативных изменений слизистой оболочки матки обсуждают в связи с повышением их концентрации при ГПЭ.
Несмотря на большое число работ о значимости эндогенных и экзогенных эстрогенов в развитии ГПЭ, эстрогены не являются канцерогенами в классическом смысле этого слова, они не повреждают ДНК. Эстрогены стимулируют деление клеток, увеличивая количество пролиферирующих клеток, то есть эстрогены стимулируют уже запущенные стадии канцерогенеза.
Немаловажную роль в повышении концентрации эстрогенов и генезе пролиферативных процессов эндометрия играют нейрогуморальные расстройства и нарушения обмена веществ, возникающие в результате сопутствующих экстрагенитальных нарушений.
Общепризнано, что ожирение может являться одним из факторов риска патологических состояний эндометрия. При этом степень выраженности пролиферативных изменений находится в прямой зависимости от степени ожирения. Так, при незначительном ожирении относительный риск рака эндометрия возрастает примерно в 2 раза, а при выраженной форме он увеличивается в 10 раз.
Ожирение как патологическое состояние, способствующее развитию гипер и неопластических процессов эндометрия, рассматривается в нескольких аспектах: вопервых, как источник эндогенного образования эстрогенов из андрогенов; вовторых, как комплекс метаболических сдвигов, создающих потенциальные условия для развития опухолей. Известно, что тиреоидные гормоны модулируют действия эстрогенов на клеточном уровне. Заболевания щитовидной железы, сопровождающиеся дисбалансом секреции этих гормонов, могут способствовать прогрессированию нарушений гисто и органогенеза гормонзависимых структур и формированию гиперпластических процессов эндометрия.
Многие авторы связывают развитие пролиферативных процессов эндометрия также с дисфункцией коры надпочечников. В постменопаузе повышается активность коры надпочечников. А надпочечниковые андрогены способны оказывать влияние на гормончувствительные ткани как путём периферической конверсии в эстрон, так и при прямом контакте со стероидными рецепторами эндометрия.
Патология гепатобилиарной системы играет роль при развитии хронической гиперэстрогении вследствие замедленной утилизации эстрогенов в печени. По данным литературы, у трети больных с гиперплазией эндометрия встречаются хронические холециститы, гепатиты, дискинезия желчевыводящих путей.
До сих пор считается справедливой концепция Я.В. Бохмана о двух патогенетических вариантах пролиферативных процессов эндометрия. Первый (гормонозависимый) вариант встречается в 60–70% случаев патологии эндометрия и характеризуется хронической гиперэстрогенией и нарушениями жирового и углеводного обмена. Клинический симптомокомплекс проявляется маточными кровотечениями, поздним наступлением менопаузы, сочетанием гиперплазии с опухолями яичников, частым наличием ММ и аденомиоза; диффузной гиперплазией в ткани эндометрия, на фоне которой возникают полипы, очаги атипической гиперплазии и рак; обменными нарушениями в виде ожирения, гиперлипидемии и сахарного диабета. При втором (автономном) патогенетическом варианте, обнаруживающемся у 30–40% больных, эндокриннообменные нарушения выражены нечётко или вообще отсутствуют, характерно сочетание фиброза стромы яичников и атрофии эндометрия, на фоне которой обнаруживают полипы, атипическую гиперплазию или рак, нередко без клинических проявлений.
Благодаря исследованиям последних 20 лет в области гормонрецепторных взаимодействий появилась возможность уточнения патогенеза гиперпластических процессов эндометрия, при этом значительную роль отводят нарушениям тканевой рецепции. Установлено, что чувствительность слизистой оболочки матки к стероидам регулируют специфические цитоплазматические и ядерные рецепторы. Модель гормонрецепторного взаимодействия состоит из нескольких этапов.
Свободные фракции половых стероидов путём диффузии поступают в гормоночувствительную клетку, где взаимодействуют со специфическими лигандсвязывающими доменами рецепторов. Рецептор, активированный лигандом (эстрадиолом, прогестероном) взаимодействует со специфическими участками ДНК в промоторной зоне генов, ответственных за гормональный ответ, что приводит к продукции мРНК. Таким образом, гормон модулирует функциональную активность клетки.
Рецепторный статус эндометрия зависит от возраста женщины и характера патологии эндометрия. Так, в постменопаузе отмечено снижение концентрации стероидных рецепторов пропорцонально длительности периода постменопаузы. Мнение различных исследователей о содержании рецепторов в патологически изменённом эндометрии неоднозначно, хотя большинство авторов отмечают зависимость их содержания от формы патологии. Наиболее высокие концентрации цитозольных ЭР и ПР выявлены при полипах эндометрия. Это сочеталось с отсутствием нарушений гормонального статуса и позволило высказать предположение об их относительной автономности. Многие исследователи указывают на повышенное содержание ЭР при железистой гиперплазии эндометрия, постепенное их уменьшение при атипической гиперплазии эндометрия и низкое содержание при раке эндометрия.
В регуляции пролиферативной активности клеток эндометрия наряду с эстрогенами участвуют биологически активные соединения, такие как полипептидные факторы роста, цитокины, метаболиты арахидоновой кислоты, а также системы клеточного и гуморального иммунитета.
Изменения рецепторного аппарата клеток эндометрия могут быть также обусловлены травматическими повреждениями слизистой оболочки матки при многократных абортах и диагностических выскабливаниях, а также воспалительными процессами, которые определяют у 46–59% больных с ГПЭ.
У пациенток с ГПЭ, высокой частотой хронических ВЗОМТ и большим количеством внутриматочных вмешательств в анамнезе при исследовании соскобов эндометрия были выявлены гистологические признаки эндометрита. Важную роль при этом отводят возрастным иммунодефицитным состояниям, снижающим резистентность организма к действию многих повреждающих агентов, в том числе и к микроорганизмам. В этих условиях все биологические барьеры, препятствующие проникновению инфекции, оказываются нарушенными. В результате развивается хронический воспалительный процесс, который ведёт к возникновению диффузной гиперплазии эпителия, а затем и очаговых пролифератов.
Работы последних лет показали существенную роль изменений иммунной системы в патогенезе гиперплазии эндометрия. Функциональное состояние Т и Всистем иммунитета у женщин с гиперпластическими процессами эндометрия характеризуется угнетением активности Тклеток и снижением количества Вклеток. При этом снижение показателей клеточного и гуморального иммунитета зависит от выраженности пролиферации железистого эпителия. Пролиферация наиболее выражена у больных предраком эндометрия и практически отсутствует у пациенток с фиброзными полипами эндометрия. Кроме того, снижение иммунитета прогрессирует с возрастом и наиболее выражено после 60 лет.
В регуляции процессов тканевого гомеостаза и патогенезе пролиферативных заболеваний важная роль принадлежит не только усилению процессов клеточной пролиферации, но и нарушению регуляции клеточной гибели. Резистентность клеток эндометрия к запрограммированной клеточной гибели (апоптозу) приводит к накоплению изменённых и избыточно пролиферирующих клеток. Это ― характерная черта неопластических изменений эндометрия. Доказано, что апоптоз регулируют различные гены. В настоящее время описано более 60 генов (протоонкогенов), которые кодируют белки, участвующие в регуляции роста клеток, и являются потенциальными индукторами опухолей.
Изучение апоптоза как одной из возможных причин развития пролиферативных изменений эндометрия важно для совершенствования их терапии. В последние годы получены данные о возможности восстановления способности клеток к апоптозу под воздействием различных антигормонов: антиэстрогенов при раке молочной железы, антипрогестинов при раке эндометрия.
Таким образом, сложное взаимодействие общих системных процессов (нейроэндокринных, метаболических, иммунных) и локальных изменений (рецепторного и генетического аппарата эндометриальных клеток), а также участие ряда биологически активных соединений (факторов роста и апоптоза, цитокинов, простагландинов и метаболитов арахидоновой кислоты) обусловливают патогенез пролиферативных процессов эндометрия.
КЛИНИЧЕСКАЯ КАРТИНА ГПЭ
Основные клинические проявления ГПЭ ― маточные кровотечения, чаще ациклические, контактные кровяные выделения, реже ― меноррагии. В репродуктивном возрасте кровотечение происходит по типу менометроррагии, в пременопаузальном ― ациклические кровотечения, в постменопаузе ― в виде кровянистых выделений различной интенсивности, чаще мажущего характера. При полипах эндометрия больших размеров могут быть схваткообразные боли в низу живота. Иногда полипы эндометрия протекают бессимптомно.
Учитывая, что патогенетическую основу гиперплазии эндометрия составляет ановуляция, ведущим симптомом больных репродуктивного возраста считают бесплодие, как правило первичное.
Роль полипов эндометрия в бесплодии и невынашивании беременности до сих пор дискутируется. Вместе с тем при обследовании женщин с бесплодием у 24% обнаруживают полипы эндометрия.
Я.В. Бохман (1989) выделил два клинических варианта ГПЭ:
1. Первый (гормонозависимый) вариант. Наблюдается у 60—70 % больных с АГЭ, характеризуется выраженной гиперэстрогенией и метаболическими нарушениями (особенно жирового и углеводного обменов). У больных отмечаются ановуляторные маточные кровотечения, бесплодие, проявления склерополикистоза яичников (синдром Штейна-Левенталя), миома матки (при ожирении и сахарном диабете). Наряду с АГЭ выявляются полипы с увеличенными дегенеративными яичниками за счет гиперплазии тека-клеток.
2. Второй (автономный) вариант. Встречается у 30—40 % больных. Эндокринные нарушения не выражены или отсутствуют. АГЭ в сочетании с полипами развивается на фоне атрофических процессов эндометрия вместе с фиброзом стромы яичников. При этом выражены явления иммуносупрессии. Отмечается гипоэстрогения, повышение уровня кортизола и снижение содержания клеточных рецепторов в эндометрии при выраженной депрессии Т-лимфоцитов.
Жалобы больных с гиперпластическими процессами эндометрия можно разделить на 3 группы: связанные с нарушением менструальной функции (кровянистыми выделениями из половых путей); обусловленные болевым синдромом или контактными кровянистыми выделениями; вызванные обменными или эндокринными нарушениями.
Главным клиническим проявлением всех вариантов ГПЭ являются дисфункциональные маточные кровотечения. В реп-родуктивном возрасте больные жалуются на кровянистые выделения из половых путей в межменструальный период. В климактерическом периоде женщин беспокоят нерегулярные менструации с последующей мазней (при полипозе) или кровотечением (при железистой гиперплазии и аденоматозе). В менопаузе больные отмечают скудные, кратковременные или длительные кровянистые выделения.
Иногда больных беспокоят умеренно выраженные боли внизу живота и контактные кровотечения.
Жалобы, обусловленные обменными и эндокринными нарушениями, особенно часто предъявляют больные аденоматозом. Наиболее характерными для них являются жалобы на головные боли, избыточную прибавку массы тела, патологическое оволосение, нарушение сна, периодически возникающая жажда, розовые стрии, пониженная работоспособность, раздражительность.
Из экстрагенитальных заболеваний часто отмечается ожирение и артериальная гипертензия. Второе место по частоте занимают болезни печени.
ДИАГНОСТИКА ГПЭ
Основными методами диагностики ГПЭ на современном этапе являются трансвагинальное УЗИ, гидросонография, гистероскопия и гистологическое исследование.
Порядок диагностики:
1. Жалобы больной.
2. Анамнез жизни (нарушения жирового и углеводного обменов, гипертензия, болезни печени).
3. Гинекологический анамнез (нарушения менструального
цикла с кровотечениями, бесплодие, миома матки, мастопатия).
4. Гинекологический осмотр.
5. Бактериологическое и бактериоскопическое обследование.
6. Гормональное обследование (эстрогены, прогестерон, гормоны щитовидной железы и надпочечников).
7. Гистологическое исследование полного соскоба слизистой. Выскабливание эндометрия следует проводить накануне ожидаемой менструации или в ее первые часы. Особенно тщательно необходимо удалить слизистую в области дна матки и ее трубных углов.
8. Гистероскопия проводится как до выскабливания — для уточнения характера патологической трансформации эндометрия, так и после него — с целью контроля за тщательностью выполненной операции.
9. УЗ-исследование с использованием трансвагинального датчика. При подозрении на гиперпластический процесс и рак тела матки особое внимание уделяется изучению срединного маточного эха (М-эха) — отражение от эндометрия и стенок полости матки. Оценивают его форму, контуры и внутреннее строение. Определяют величину переднезаднего размера (ПЗР) М-эха. В репродуктивном периоде максимальное значение ПЗР неизмененного М-эха наблюдается в период расцвета желтого тела (секреторная фаза менструального цикла) и колеблется в пределах 10—16 мм. Основным критерием ГПЭ в репродуктивном периоде является увеличение его толщины во II второй фазе МЦ более 16—18 мм, а в постменопаузе — более 5 мм.
При гиперплазии эндометрия в зоне расположения М-эха выявляются овальные образования, увеличенные в передне-заднем направлении с однородной структурой и повышенной эхоплотностью (I тип эхограмм). Для второго типа эхограмм характерно появление ровных утолщенных (до 4—7 мм) контуров эндометрия с низким уровнем звукопроводимости, отграничивающих гомогенную зону с меньшим волновым импульсом.
УЗИ полипов эндометрия: внутри расширенной полости матки визуализируется округлое или овальное образование с ровными контурами и высокой эхоплотностью. М-эхо отличается выраженным полиморфизмом.
При наличии маточного кровотечения граница между контурами эндометрия и полипом усиливается и определяется на сканограммах в виде эхонегативного ободка — акустической тени, отражающей скопление крови. Дифференциально-диагностический критерий полипов эндометрия — отсутствие деформации М-эха.
УЗИ-показания для морфологического исследования:
1. В пременопаузе и репродуктивном периоде: увеличе-ние толщины эндометрия >16 мм; эндометриально-маточный коэфициент (ЭМК) — отношение толщины
эндометрия к величине передне-заднего размера матки >0,33. 2. В постменопаузе: увеличение толщины эндометрия >5 мм; ЭМК>0,15; обширная сквамозная дифференциация; воспалительные процессы в эндометрии.
10. Радиоизотопное исследование матки. Сущность метода заключается в оценке степени поглощения тканями радиоактивного препарата в зависимости от активности пролиферативных процессов. Интенсивность поглощения радиоактивного препарата тканями при ГЭ выше, чем при нормальном эндометрии, а при АГЭ выше, чем при железисто-кистозной гиперплазии. Чаще используется радиоактивный фосфор, накопление которого в матке повышается в следующей последовательности: вторая фаза нормального менструального цикла — доброкачественные формы ГПЭ — аденоматоз — рак.
11. Определение активности ферментов нуклеотидного обмена. В сыворотке крови определяют ферменты нуклеотидного обмена: тимидинфосфорилазу (ТФ), аденозиндезаминазу (АДА). Максимальное увеличение ТФ (в 1,9 раза) и АДА (в 3,5 раза) отмечается при аденоматозной гиперплазии. При железисто-кистозной гиперплазии уровень активности ТФ превышает нор-мальный в 1,4 раза. Уровень активности АДА наибольший при аденоматозных изменениях эндометрия, при полипах она ниже в 1,4 раза, при железисто-кистозной гиперплазии — в 1,6 раза.
ТРАНСВАГИНАЛЬНОЕ УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
Трансвагинальное ультразвуковое исследование ― скрининговый высокоинформативный метод диагностики патологии половых органов. При УЗИ оценивают характер Мэхо: в периоде постменопаузы Мэхо не должно превышать 4–5 мм по толщине, быть равномерным, структура его однородной (рис. 24-1). У менструирующих Мэхо интерпретируют с учётом фазы менструального цикла. Оптимальный срок для исследования ― сразу после менструации на 5–7й день цикла. Тонкое однородное Мэхо соответствует полному отторжению функционального слоя эндометрия, тогда как локальное или равномерное увеличение толщины Мэхо следует расценивать как патологию. Максимальную толщину срединной структуры матки в норме наблюдают в секреторной фазе (12–28й день), она не должна превышать 12–15 мм. У пациенток периода постменопаузы, получающих ЗГТ, толщину Мэхо целесообразно оценивать индивидуально, в зависимости от вида, режима и доз ЗГТ. Превышение толщины Мэхо более 5–8 мм требует более углублённого обследования, взятия биоптата эндометрия для гистологического исследования.
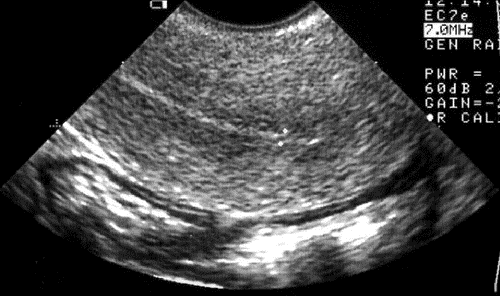 Рис. 24-1. Ультразвуковая картина атрофии эндометрия.
Рис. 24-1. Ультразвуковая картина атрофии эндометрия.
Информативность эхографии в диагностике гиперплазии эндометрия колеблется от 60% до 93,3% в зависимости от возрастного периода жизни женщины. Для гиперплазии эндометрия патогномоничными ультразвуковыми признаками являются ровные контуры Мэхо, увеличение переднезаднего размера свыше возрастной нормы, негомогенная структура
М-эхо либо повышенная эхоплотность, наличие эхонегативных включений (рис. 24-2). Отличить железистую гиперплазию эндометрия от атипической при УЗИ не представляется возможным.
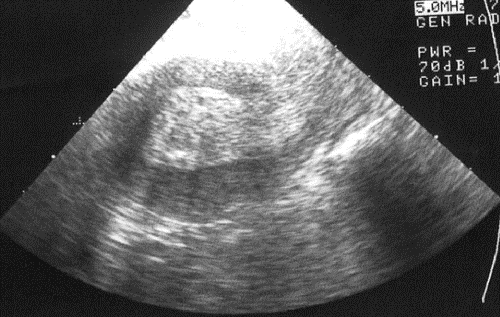
Рис. 24-2. Ультразвуковая картина гиперплазии эндометрия.
При полипах эндометрия точность ультразвуковой диагностики достигает 80–98%. Информативность эхографии снижают ожирение, спаечный процесс в малом тазу, ММ и аденомиоз, низкая разрешающая способность аппаратуры. Облегчает диагностику наличие жидкости в полости матки (менструальная кровь, серозометра), благодаря чему происходит контрастирование полости матки и достигается чёткость визуализации полипа. Диагностическими признаками полипа эндометрия являются локальное либо равномерное (при больших полипах) утолщение М-эхо, наличие включений в структуре М-эхо, повышенной либо неравномерной эхогенности округлой или овоидной формы (рис. 24-3). В 40% наблюдений в структуре включения регистрируются эхосигналы кровотока при допплеровском исследовании. При УЗИ затруднена диагностика железистых полипов, которые за счёт конфигурации по форме полости матки имеют уплощённую листовидную форму, звукопроводимость полипов близка к эндометрию.
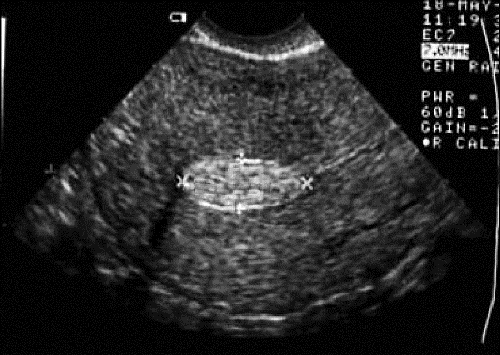
Рис. 24-3. Ультразвуковая картина полипа эндометрия.
Наличие жидкости в полости матки (серозометра) в постменопаузе может быть обусловлено возрастным стенозом шейки матки либо начальными проявлениями патологии эндометрия. При ультразвуковых признаках атрофии эндометрия больным с серозометрой показано динамическое наблюдение. При утолщении эндометрия, неровных контурах полости матки, наличии включений в полости (признаки патологии эндометрия) показана гистероскопия, раздельное диагностическое выскабливание с гистологическим исследованием соскобов.
УЗ-критерии различных видов патологии эндометрия
| Виды патологии эндометрия |
УЗ признаки | ||||
| Структура | Включения | Звуко-проводи-мость | Внешний контур М-эха | Рельеф полости | |
| Простая ГПЭ | неодно-родная (+) |
мелкие мно-жественные эхопози-тивные | увеличена | ровный | неиз-менен |
| Аденоматоз-ная ГПЭ | неодно-родная (++) |
мелкие мно-жественные эхонега-тивные | незначи-тельно увеличена | ровный | неиз-менен |
| Полипы | неодно-родная (+++) |
разной плотности и размеров |
средняя или резко увеличена |
округлые образования разного диаметра |
дефор-мирован |
| Атипичес-кая ГПЭ | неодно-родная (+++) | мелкие эхо-позитивные или эхоне-гативные | увеличена | преиму-щественно неровный, иногда отсутствие границ с миометрием | неизме-нен или дефор-мирован |
В последние годы при внутриматочной патологии применяют трансвагинальную эхографию с контрастированием полости матки (гидросонография), информативность которой при ГПЭ составляет 78–99%. Гидросонография позволяет дифференцировать полипы эндометрия (рис. 24-4), внутриматочные синехии, субмукозную миому (рис. 24-5), точно определить топографию патологического процесса. Однако метод в силу трудоёмкости и инвазивности не может быть использован в качестве скринингового. Гидросонография не заменяет по информативности гистероскопию. Поэтому гидросонографию следует расценивать как метод разрешения диагностических трудностей, её целесообразно выполнять тогда, когда УЗИ не позволяет исключить или подтвердить патологию эндометрия, и решают вопрос о гистероскопии.
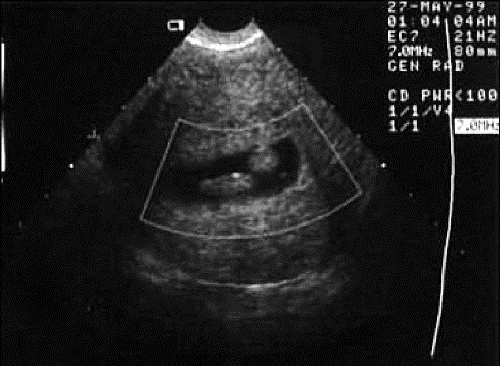
Рис. 24-4. Гидросонография. Полип эндометрия.
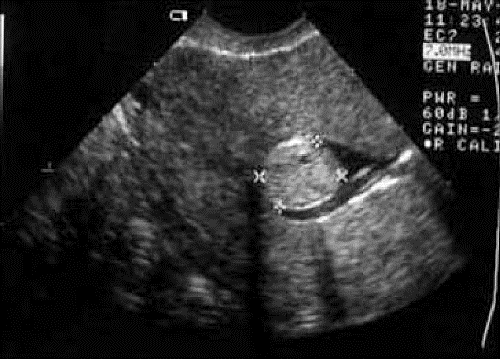
Рис. 24-5. Гидросонография. Субмукозная миома матки.
ГИСТЕРОСКОПИЯ
Среди инструментальных исследований гистероскопию считают наиболее информативным методом диагностики состояния полости матки и эндометрия. Визуальный осмотр полости матки позволяет с большой точностью обнаружить внутриматочную патологию, провести топическую диагностику и, при необходимости, прицельную биопсию или хирургическое вмешательство в пределах полости матки. Гистероскопия необходима как перед выскабливанием слизистой матки для верификации характера патологии и её локализации, так и после него с целью контроля за тщательностью проведённой операции. Окончательным методом диагностики патологии эндометрия служит гистологическое исследование удалённой ткани при диагностическом выскабливании. Даже опытным гинекологам при раздельном диагностическом выскабливании слизистой оболочки матки без гистероскопии в 43–96% наблюдений не удаётся удалить полностью или диагностировать патологический субстрат в матке.
Информативность гистероскопии в диагностике гиперплазии эндометрия, по данным разных исследователей, составляет 63–97,3%. Ложноположительные результаты чаще встречаются в репродуктивном возрасте, чем в постменопаузе, и составляют 42 и 28% соответственно.
Гистероскопическая картина гиперплазии эндометрия бывает различной и зависит от характера гиперплазии (обычная или полиповидная), распространённости (очаговая или диффузная), наличия кровотечения и его длительности (рис. 24-6).
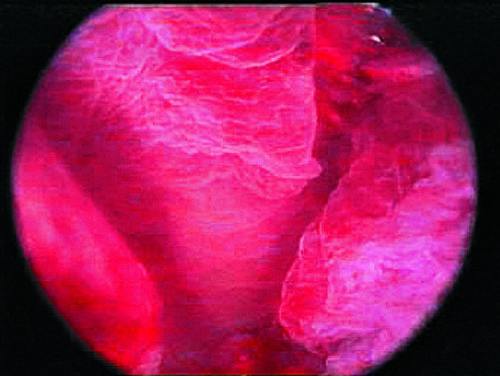
Рис. 24-6. Гистероскопия. Гиперплазия эндометрия.
При обычной гиперплазии и отсутствии кровяных выделений эндометрий утолщён в виде складок различной высоты, бледнорозового цвета, отёчный, просматривается большое количество протоков желёз (прозрачные точки). При изменении скорости потока жидкости в полость матки отмечают волнообразное движение эндометрия. Если гистероскопию проводят при наличии длительных кровяных выделений, чаще в дне матки и в области устьев маточных труб определяют бахромчатые обрывки эндометрия бледнорозового цвета, на остальном протяжении эндометрий тонкий, бледный. Эндометрий на описанной гистероскопической картине трудно отдифференцировать от эндометрия в фазе ранней пролиферации. Окончательный диагноз ставят при гистологическом исследовании соскоба из матки.
При полиповидной форме гиперплазии эндометрия поверхность эндометрия выглядит неровной в виде ямок, кист, бороздок, имеет полиповидную форму, бледнорозовый цвет. Величина полипов колеблется от 0,1x0,3 до 0,5–1,5 см. Как правило, в дне матки выраженность описанных изменений более интенсивна (рис. 24-7). Полиповидную гиперплазию эндометрия, особенно при проведении гистероскопии накануне менструации, трудно отдифференцировать от эндометрия в фазе поздней секреции. В подобных случаях для постановки диагноза необходимо сопоставить характер гистероскопической картины с клинической картиной заболевания, днем менструального цикла.
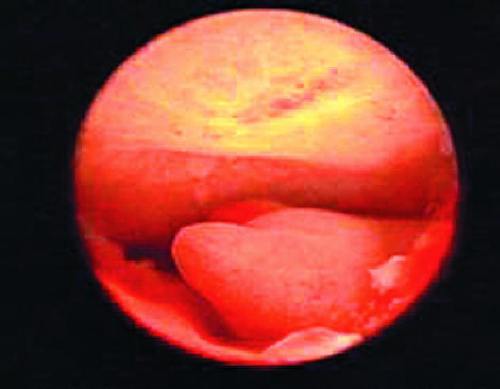
Рис. 24-7. Гистероскопия. Полиповидная гиперплазия эндометрия.
Атипическая гиперплазия эндометрия и очаговый аденоматоз не имеют характерных эндоскопических критериев, и их гистероскопическая картина напоминает обычную железистокистозную гиперплазию. При тяжёлой форме атипической гиперплазии могут определять железистые полиповидные тусклые разрастания желтоватого или сероватого цвета. Как правило, окончательный диагноз ставят после гистологического исследования (рис. 24-8).
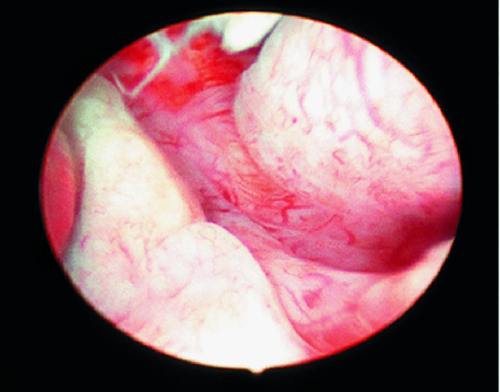
Рис. 24-8. Гистероскопия. Атипическая гиперплазия эндометрия.
ГИСТЕРОСКОПИЧЕСКИЕ КАРТИНЫ ПРИ ПОЛИПАХ ЭНДОМЕТРИЯ
*Простая гиперплазия: эндометрий неравномерно утолщен, имеет складчатое строение; основание складок широкое, вершина тонкая с неровными краями, цвет складок от бледно-розового до ярко-красного. Характерен признак «подводных растений» — волнообразные движения слизистой оболочки при изменении давления в полости матки во время ее растяжения
жидкими средами. Высота слизистой 10—15 мм. Сосудистый рисунок резко выражен. Выводные протоки трубчатых желез четко визиализируются, расположены равномерно. Устья маточных труб свободны.
Кистозная форма железистой ГЭ характеризуется наличием множественных кистозных полостей, расположенных в проекции поверхностных кровеносных сосудов слизистой, имеющих различную толщину (феномен «ловушки»). Диаметр кистозных структур 2 — 3 мм.
Полиповидная форма ГЭ характеризуется появлением множества полиповидных разрастаний (шарообразные структуры на широком основании) бледно-розового или сине-багрового цвета, свисающих в просвет полости матки, величина их колеблется от нескольких мм до 1—1,5 см. Устья маточных труб не идентифицируются. Выводные протоки желез не определяются. Сосудистый рисунок резко выражен.
Полипы, покрытые функциональным слоем, имеют гладкую поверхность и бледно-розовый цвет. Располагаются в области дна и трубных углов матки.
Железистые и железисто-фиброзные полипы бледно-розовые или бледно-серые, располагаются в области дна и углов матки, резко выражен сосудистый рисунок (расширены периферические сосуды).
Фиброзные полипы: округлые или овальные образования, бледно-розового или бледно-желтого цвета, с гладкой поверхностью и широким основанием. Сосудистый рисунок не идентифицируется. Размеры полипов 15 мм, как правило, они единичные.
Полипы с очаговым аденоматозом имеют такую же эндоскопическую картину, что и железистые или железисто-фиброзные полипы.
Аденоматозные полипы: тускло-серые образования с неровной поверхностью. Величина — 5—30 мм. Иногда поверхность имеет багрово-синюшный цвет (локальное нарушение кровообращения) или выраженный сосудистый рисунок (многочисленные расширенные капилляры).
Рак эндометрия: папилломатозные разрастания серого или грязно-серого цвета с участками кровоизлияния и некроза.
Сосудистый рисунок усиленный. При изменении объема вводимой жидкости ткань легко распадается, кровоточит и крошится.
Фиброзные полипы эндометрия при гистероскопии определяют как единичные образования бледного цвета, округлой или овальной формы, чаще небольших размеров (от 0,5x1 до 0,5–1,5 см). Они имеют ножку плотной структуры, гладкую поверхность, маловаскуляризированы (рис. 24-9). Фиброзные полипы эндометрия могут быть больших размеров (рис. 24- 10), и при гистероскопии их воспринимают как стенку матки изза плотного прилегания полипа к ней. При осмотре полости матки необходимо помнить о последовательности осмотра всех стенок матки и об ориентирах полости (устья маточных труб). Телескоп следует постепенно извлекать до внутреннего зева, тем самым создавая возможность панорамного осмотра всей полости матки. Фиброзные полипы напоминают подслизистые миоматозные узлы. При обнаружении полипа необходимо обследовать его со всех сторон, оценить величину, локализацию, место прикрепления, величину ножки.
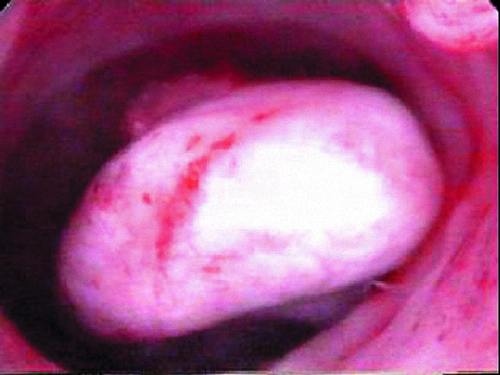
Рис. 24-9. Гистероскопия. Фиброзный полип эндометрия.
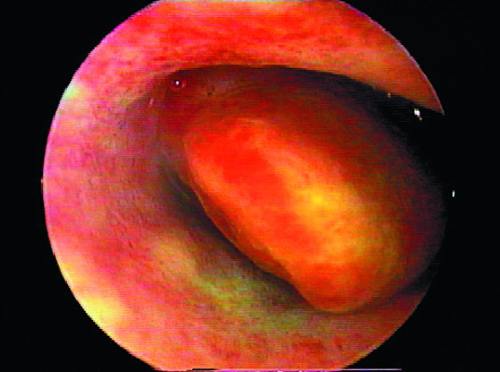
Рис. 24-10. Гистероскопия. Полип эндометрия на фоне атрофии эндометрия.
Железистокистозные полипы эндометрия, в отличие от фиброзных, чаще бывают больших размеров (от 0,5x1 до 5– 6 см), определяют их как единичные образования, может быть одновременно и несколько полипов. Форма полипов продолговатая, конусовидная, неправильная (с перемычками). Поверхность гладкая, ровная, в некоторых случаях над ней выступают кистозные образования с тонкой стенкой и прозрачным содержимым. Цвет полипов бледнорозовый, бледножёлтый, сероваторозовый. Нередко верхушка полипа бывает тёмнобагрового или синюшнобагрового цвета. На поверхности полипа видны сосуды в виде капиллярной сети (рис. 24-11).
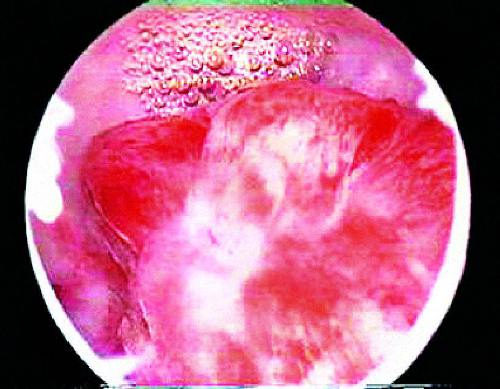
Рис. 24-11. Гистероскопия. Железисто-кистозный полип эндометрия.
Аденоматозные полипы эндометрия чаще всего локализуются ближе к устьям маточных труб и, как правило, бывают небольших размеров (0,5x1 и 0,5x1,5 см), выглядят более тусклыми, серыми, рыхлыми (рис. 24-12).
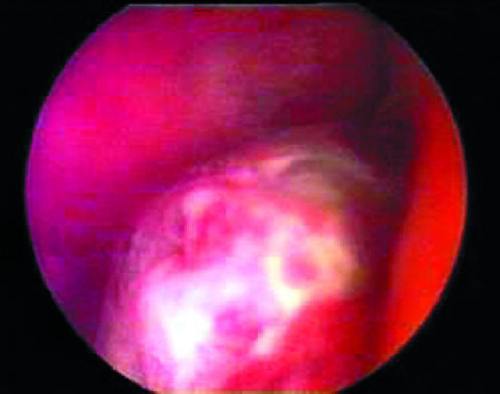
Рис. 24-12. Гистероскопия. Аденоматозный полип эндометрия.
Аденоматозные изменения могут определять и в ткани железистокистозных полипов. В этом случае характер полипа при эндоскопическом исследовании определить невозможно.
Характерная особенность полипов эндометрия — изменчивость их формы при изменении скорости подачи жидкости или газа в полость матки. Полипы при этом сплющиваются, увеличиваются в диаметре, при уменьшении давления они вытягиваются в длину и совершают колебательные движения.
Полипы эндометрия в постменопаузе, как правило, бывают одиночными, реже два и очень редко три полипа. Их определяют всегда на фоне атрофичной слизистой оболочки. Иногда они достигают больших размеров и, выходя за пределы шейки матки, имитируют полипы цервикального канала (рис. 24-13). В репродуктивном и пременопаузальном периодах жизни женщины полипы эндометрия как гистологически самостоятельную форму могут определять как на фоне гиперплазии эндометрия, так и при нормальной слизистой оболочке различных фаз менструального цикла.
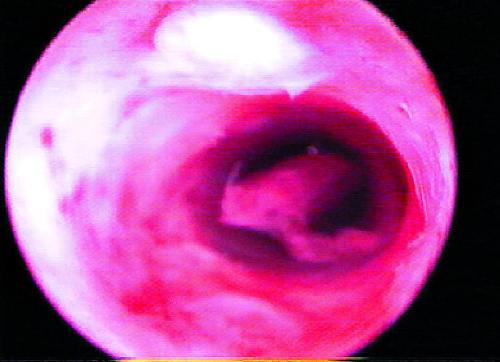
Рис. 24-13. Гистероскопия. Полип эндометрия. выходящий за пределы цервикального канала.
Гистологическое исследование соскобов слизистой матки ― окончательный метод диагностики ГПЭ.
Цитологическое исследование аспирата из полости матки используют при динамическом наблюдении за эффективностью гормональной терапии и как скрининговый метод при диспансерном обследовании. Цитологическое исследование, являясь минимально инвазивным, позволяет определить выраженность пролиферативных изменений эндометрия (см. главу «Аспирационная биопсия эндометрия»).
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При обнаружении ГПЭ у пациенток репродуктивного периода важно распознать причины, вызвавшие патологию в эндометрии. Обязательным для этой возрастной группы должно быть обследование по тестам функциональной диагностики: измерение ректальной температуры, исследование гормонального статуса (гормоны гипофиза, яичников), обследование щитовидной железы. В зависимости от обнаруженных изменений ― консультации специалистов (эндокринолога, невропатолога, терапевта).
У пациенток пери и постменопаузального возраста для выбора терапии необходимо углублённое обследование для обнаружения сопутствующих заболеваний (биохимическое исследование крови, сахар крови, контроль АД, УЗИ брюшной полости и др.).
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
У пациенток репродуктивного и пременопаузального периодов с маточными кровотечениями при отсутствии органической патологии матки (миома, аденомиоз) и опухолей яичников диагноз следует формулировать следующим образом: «дисфункциональное маточное кровотечение репродуктивного или пременопаузального возраста». У пациенток периода постменопаузы допустимо использование гистологического заключения при формулировке диагноза: «полип эндометрия», «гиперплазия эндометрия».

