ЛЕЧЕНИЕ ГИПЕРПЛАЗИИ ЭНДОМЕТРИЯ И ПОЛИПОВ ЭНДОМЕТРИЯ
ЦЕЛИ ЛЕЧЕНИЯ
Цель лечения ГПЭ ― профилактика рака эндометрия и купирование клинических проявлений патологических изменений эндометрия (менометроррагий у пациенток репродуктивного и пременопаузального возраста).
Лечение гиперпластических процессов эндометрия остаётся одной из важных проблем гинекологии. Лечебная тактика при ГПЭ зависит от патоморфологической характеристики эндометрия, возраста пациентки, этиологии и патогенеза заболевания, сопутствующей гинекологической и экстрагенитальной патологии. Терапия в различные возрастные периоды складывается из остановки кровотечения, восстановления менструальной функции в репродуктивном периоде или стойкой постменопаузы в более старшем возрасте и профилактики рецидива гиперпластического процесса.
*Лечение ГПЭ состоит из 4-х этапов:
I этап лечения — остановка кровотечения.
Метод остановки кровотечения в ювенильном возрасте определяется общим состоянием больной, величиной крово-потери и анемизацией. При удовлетворительном состоянии наиболее часто применяется гормональный гемостаз: эстроген-гестагенные препараты (логест, фемоден, жанин, ярина и др.) в гемостатическом режиме (в 1-й день 3-5 таблеток с последующим постепенным снижением дозы до 1 таблетки в день с общей продолжительностью приема в течение 21 дня).
Девочкам, поступившим в стационар в тяжелом состоянии и обильным кровотечением, постгеморрагической анемией (содержание НЬ < 70 г/л и падение гематокрита до 20 %), понижением АД и тахикардией, следует провести выскабливание слизистой оболочки матки с гистероскопическим контролем и предварительной профилактикой разрыва девственной плевы (местное введение 64 ЕД лидазы с 0,25 % раствором новокаина). Выскабливание проводится с письменного согласия родителей, близких родственников или опекунов.
Остановка маточных кровотечений у женщин репродуктивного и климактерического возраста проводится с помощью выскабливания эндометрия с его последующим гистологическим исследованием.
Используют также утеротонические средства: холод на низ живота, окситоцин, настойка водяного перца, отвар крапивы. Антианемическая терапия: переливание крови и эритроцитар-ной массы, плазмы, применение препаратов железа (ферковен, ферроплекс, тардиферрон, ферум-лек). Инфузионная терапия для улучшения реологических свойств крови и нормализации водно-электролитного баланса: стабизол, рефортан, реополиглюкин, желатиноль, солевые изотонические растворы, 5—10 % растворы глюкозы.
Гемостатики: 10 % раствор кальция глюконата по 10 мл в/в или в табл. по 0,5 г 3—4 раз/сут.; 5 % раствор эпсилон-аминокапроновой кислоты по 100 мл в/в или по 2—3 г в порошках 3 раз/сут.; 1 % раствор викасола по 3 мл в/м в течение 3-х дней; дицинон по 250 мг 3 раз/сут.
Витамины и энергетические средства: витамин В12 по 200 мг в день в/м; витамин В6 по 1 табл. (5 мг) 2—3 раз/сут. или по 1 мл 5 % раствора в/м; фолиевая кислота по 1 табл. (1 мг) 2—3 раз/ сут.; 5 % раствор аскорбиновой кислоты по 5—10 мл 1 раз/сут. в/в или по 250 мг 2 раз/сут.; рутин по 1 табл. (2 мг) 3 раз/сут.; кокар-боксилаза по 50 мг в/в или в/м; АТФ по 2 мл в/м.
II этап — гормонотерапия, направленная на супрессию эндометрия.
«Чистые» гестагены (патогенетически обоснованная терапия ГПЭ). Лечение проводят в течение 3-6 мес. с 16-го по 25-й день менструального цикла, с 5-го по 25-й день МЦ или в непрерывном режиме в зависимости от возраста женщины (таблица 7.1):
♦ норколут, примолют-нор, норлютен (норэтистерона ацетат) — по 5 мг с 16 по 25-й день цикла;
♦ прогестерон — 10 мг (1 мл 1 % р-ра) в/м с 16-го по 25-й день цикла. Курсовая доза 240—480 мг;
♦ 17-ОПК— 125 мг (1 мл 12,5 % р-ра) в/м на 14-й и 25-й дни цикла. Курсовая доза 750—1500 мг;
♦ утрожестан — по 100 мг 2—3 раз/сут., с 16-го дня МЦ в течение 10—14 дней;
♦ дуфастон (дидрогестерон) — по 10 мг 1 раз/сут., с 16-го по 25-й день МЦ;
♦ провера (медроксипрогестерона ацетат) — по 10 мг с 16-го по 25-й день цикла;
♦ депо-провера — 200 мг в/м на 14-й и 21-й дни цикла;
♦ депостат (гестонорона капроат) — 200 мг в/м 1 раз в неделю.
Агонисты ГнРГ (для коррекции обменно-эндокринных нарушений, нормализации состояния ЦНС и вегетативной нервной системы):
♦ гозерелин (золадекс) — 3,6 мг подкожно 1 раз в 28 дней;
♦ бусерелин — 3,75 мг 1 раз в 28 дней;
♦ бусерелин спрей назальный 900 мг в сутки ежедневно.
Показания к применению агонистов ГнРГ у женщин с ГПЭ:
простая атипичная ГПЭ в пери- и постменопаузе; рецидивирующее течение простой атипичной ГПЭ в репродуктивном возрасте после монотерапии гестагенами; атипичная комплексная ГПЭ в репродуктивном возрасте и перименопаузе; простая и комплексная атипичная ГПЭ в репродуктивном возрасте; ГПЭ в сочетании с лейомиомой матки или аденомиозом.
Агонисты ГнРГ в сочетании с гестагенами применяют на протяжении 3 месяцев, а при необходимости (при отсутствии атрофии эндометрия во время контрольного гистологического исследования эндометрия после 3-месячной терапии) — до 6 месяцев. В случае подтверждения атрофии эндометрия через 3 месяца в дальнейшем проводится монотерапия гестагенами еще 3 месяца.
Монофазные эстроген-гестагенные препараты применяют по 1 табл. с 5 по 25-й день цикла у женщин репродуктивного возраста:
♦ ригевидон (0,15 мг левоноргестрела и 0,03 мг этинилэст-радиола);
♦ марвелон (дезогестрел — 0,15 мг, этинилэстрадиол — 0,03 мг);
♦ минизистон (0,125 мг левоноргестрела, 0,03 мгэтинилэс-традиола);
♦ фемоден (этинилэстрадиол — 0,03 мг, гестоден — 0,075 мг);
♦ логест (0,02 мг этинилэстрадиола и 0,075 мг гестодена);
♦ жанин (0,03 мг этинилэстрадиола и 2 мг диеногеста);
♦ ановлар (0,05 мг этинилэстрадиола и 1 мг норэтистерона);
♦ нон-овлон (0,05 мг этинилэстрадиола и 1 мг норэтистерона), в отличие от других монофазных КОК, применяют с 16-го по 25-й день цикла.
Трехфазные контрацептивы применяют с 1-го по 28-й день цикла у женщин репродуктивного возраста:
♦ триквилар
(I фаза — 6 драже — 0,05 мг левоноргестрела, 0,03 мг этинилэстрадиола;
II фаза — 5 драже — 0,075 мг левоноргестрела и
0,04 мг этинилэстрадиола;
III фаза —10 драже — 0,125 мг левоноргестрела и
0,03 мг этинилэстрадиола);
♦ тристеп
(I фаза — 6 таблеток — 0,05 мг левоноргестрела, 0,03 мг этинилэстрадиола;
II фаза — 6 табл. — 0,05 мглевоноргестрела и 0,05 мг этинилэстрадиола;
III фаза —10 табл. — 0,125 мг левоноргестрела и 0,04 мг этинилэстрадиола);
♦ тризистон
(I фаза— 6 табл., содержащих в качестве гестагена 0,05 мг левоноргестрела, в качестве эстрогена 0,03 мг этинилэстрадиола;
II фаза — 6 табл. — 0,075 мг левоноргестрела и 0,04 мг этинилэстрадиола;
III фаза —9 табл. — 0,125 мг левоноргестрела и 0,03 мг этинилэстрадиола).
III этап лечения — оптимизация гормонального статуса с целью предупреждения развития гиперэстрогении (восстановление двухфазного менструального цикла у женщин репродуктивного возраста или стойкой менопаузы в климактерическом периоде).
У молодых женщин:
1.Стимуляция овуляции кломифеном и хорионическим го-надотропином: кломифен — по 1 табл. (50 мг) с 5-го по 9-й день цикла. Под действием кломифена наблюдается одновременное созревание многих фолликулов. Для усиления эффекта назначают хорионический гонадотропин: 10000 ME профази на 14-й день или по 3000 ME хоригонина на 12,14,16 день цикла, или по 5000 ME прегнила на 13 и 15 день цикла При отсутствии эффекта доза кломифена может быть увеличена в 2 раза (во II цикле) и в 3 раза (в III цикле) под контролем размеров яичников (УЗИ). При наступлении овуляции на фоне гипопрогестеронемии допустимо назначение гестагенов во II фазе цикла в течение 10 дней: прегнин — по 0,02 г сублингвально 2 раз/сут.; норэтистерон
(норколут) — по 0,005 г 2 раз/сут.; оргаметрил (линестренол) — 0,005 г в сут.; прогестерон — 1 мл 2,5 % раствора в/м через день, 5 дней; 17-ОПК— 1 мл 12,5 % раствора в/м однократно; дидро-гестерон (дуфастон) — по 10—20 мг; утрожестан — по 200—300 мг в сутки в два приема (1 капсула утром через час после еды, 1-2 капсулы вечером). Курс лечения — 6 циклов.
Контроль гиперстимуляции яичников!
2.Стимуляция овуляции фенобарбиталом: фенобарбитал — по 200 мг в сутки, в течение 6 недель с последующим переходом на 50 мг в сутки.
3.Стимуляция овуляции с помощью ФСГ (гонал-Ф, мено-паузальный гонадотропин, метродин, урофоллитропин) и хо-рионического гонадотропина (хориогонин, профази, прегнил). Менопаузальный гонадотропин (метродин, урофоллитропин, гонал-Ф) назначают с первых дней от начала менструальной реакции по 75 ME в течение 7—12 дней (контроль УЗИ). При отсутствии эффекта дозу увеличивают— 150-225 ME. При дозревании фолликула (d — 22-25 мм) стимулируют овуляцию и образование желтого тела хорионическим гонадотропином: 10000 ME профази на 14-й день или по 3000 ME хориогонина на 12,14,16 день или по 5000 ME прегнила на 13 и 15 день.
4. Стимуляция овуляции с помощью ФСГ или ЛГ (пергонал, ху-мегон, пергогрин) и хорионического гонадотропина (хориогонин, прегнил, профази): пергонал, хумегон (по 75 ME ФСГ и 75 ME ЛГ) в/м по 1 мл от начала менструальной реакции в течение 7—12 дней. Пергогрин (по 75 ME ФСГ и 35 ME ЛГ) — такая же схема.
При дозревании фолликула (d — 22-25 мм) стимулируют овуляцию и образование желтого тела хорионическим гонадотропином: 10000 ME профази на 14-й день или по 3000 ME xo-ригонина на 12,14,16 день.
В климактерическом периоде возможно прекращение менструального цикла препаратами мужских половых гормонов:
♦ метилтестостерон по 10 — 15 мг/сутки в течение 3 месяцев;
♦ тестостерона пропионат по 20 — 25 мг/сутки в течение 3 месяцев;
♦ сустанон-250 (омнадрен-250) по 1 мл 1 раз в месяц в течение 3 месяцев.
В процессе длительной гормонотерапии целесообразно назначать препараты, улучшающие функцию печени, гипосенси-билизирующие средства, проводить витаминотерапию.
В случае неэффективности консервативной терапии ГПЭ показано ОПЕРАТИВНОЕ ЛЕЧЕНИЕ. При неатипических формах ГПЭ, особенно у женщин репродуктивного возраста, используется гистероскопическая резекция или абляция эндометрия, а при атипических формах — экстирпация матки.
Показания к оперативному лечению больных с ГПЭ
1. В репродуктивном периоде: атипическая комплексная ГПЭ при отсутствии эффекта от консервативной терапии в течение 3 месяцев; простая атипическая и комплексная неа-типическая ГПЭ при неэффективности терапии в течение 6 месяцев.
2. В климактерическом периоде: комплексная атипическая гиперплазия; простая атипическая и комплексная неатипическая ГПЭ.
При рецидивирующих полипах эндометрия показано эн-доскопическое хирургическое воздействие на зону роста («ножка» полипа), а именно криодеструкция, лазервапоризация или резектоскопия.
Абляция эндометрия
Больным без предшествующей гормональной подготов-ки проводится кюретаж или вакуум-аспирация эндометрия за 3—5 дней до абляции.
Деструкция эндометрия производится гистероскопически с помощью токов высокой частоты, используя при этом эффект рассечения, обугливания и высушивания. Рассечение тканей достигается благодаря сочетанию термоэффекта и искрового разреза. За счет обугливания тканей осуществляется гемостаз. На уровне плотного контакта электрода с тканью происходит процесс высушивания тканей с образованием струпа, а в подле-жащих слоях ткани — испарение внутриклеточной жидкости.
Методика электродеструкции: коагуляция эндометрия в области дна матки по линии, соединяющей устья маточных труб, последовательно коагуляция задней и передней стенки матки, не доходя 1 см до уровня внутреннего зева.
IV этап — последующее диспансерное наблюдение на протяжении 5 лет после эффективной гормональной терапии и 6 месяцев после оперативного лечения.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализация больных может осуществляться как в плановом, так и в экстренном порядке. Показанием для плановой госпитализации являются ультразвуковые признаки ГПЭ и кровяные выделения из половых путей (меноррагия, метроррагия, кровотечение в постменопаузе). В постменопаузе показанием для госпитализации и углубленного обследования служат также гнойные и длительные водянистые выделения из половых путей. При обильных кровяных выделениях из половых путей показана госпитализация в экстренном порядке.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ПОЛИПОВ ЭНДОМЕТРИЯ
Любой полип эндометрия, обнаруженный при гистероскопии, подлежит удалению. Многочисленными исследованиями доказано, что диагностическое выскабливание слизистой оболочки матки не позволяет полностью удалить полип эндометрия. Особенно это касается полипов с фиброзным и мышечным компонентом, которые только в 12% при кюретаже удаляют полностью. Несмотря на внедрение эндоскопического контроля в процесс хирургического удаления полипов эндометрия, частота рецидивов остаётся высокой. По данным разных авторов, она варьирует от 25,9 до 78%.
На сегодняшний день ни у кого не вызывает сомнения то, что полноценное удаление полипа эндометрия (с базальным слоем эндометрия в месте локализации полипа) возможно только при использовании гистероскопического оборудования.
Для полипэктомии можно применять как механические эндоскопические инструменты, так и электрохирургическую технику, лазерный проводник.
Удаление небольших полипов эндометрия ― наиболее частая операция. Одиночные полипы на ножке удаляют щипцами или ножницами, введёнными через операционный канал гистероскопа. Под контролем зрения их подводят к ножке полипа (рис. 24-14) и её срезают (рис. 24-15). Для удаления полипов можно использовать также петлю резектоскопа или лазерный проводник, которыми иссекают ножку полипа (рис. 24-16). После удаления полипа необходима контрольная гистероскопия для того, чтобы убедиться в том, что ножка полипа иссечена полностью.
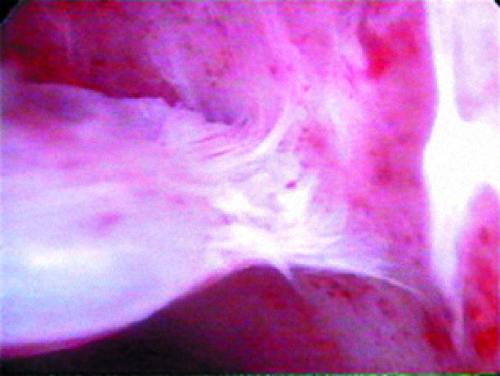
Рис. 24-14. Ножка полипа эндометрия.
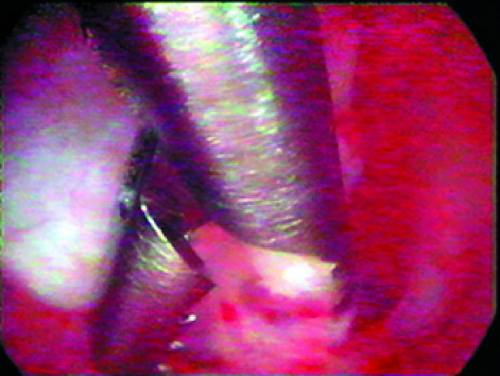
Рис. 24-15. Иссечение ножки полипа механическим инструментом.
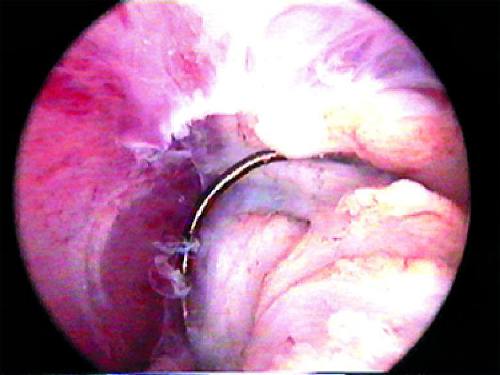
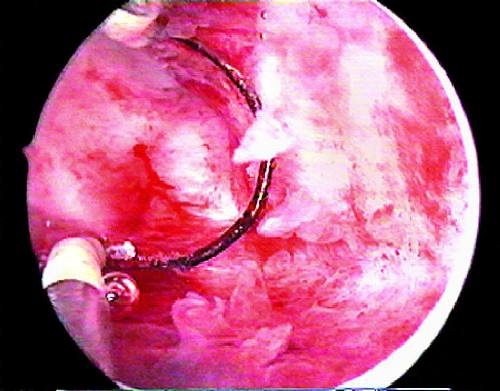
Рис. 24-16. Электрохирургическая полипэктомия (а, б).
Большие трудности связаны с удалением полипа эндометрия в области устьев маточных труб (зона наибольшей пролиферативной активности эндометрия). Это связано с высоким хирургическим риском перфорации матки, так как толщина стенок в этой области не превышает 3–4 мм. Из существующих методов прицельной полипэктомии (механического и электрохирургического) наиболее безопасен и эффективен в данном случае механический метод.
Для удаления полипов эндометрия больших размеров, фиброзных и пристеночных полипов наиболее оптимальна электрохирургическая методика с помощью резектоскопа с петлевым электродом. Петлю электрода подводят к основанию полипа и срезают полип вместе с основанием до мышечного слоя.
При использовании механического метода удаления крупных полипов эндометрия необходимо дополнительное расширение цервикального канала до № 12–13 расширителей Гегара. Затем абортцангом прицельно фиксируют полип и удаляют методом откручивания под контролем с использованием гистероскопии, нередко неоднократно до полного удаления полипа. Таким методом сложно удалить ножку полипа, если полип фиброзного строения. В таком случае приходится дополнительно иссекать ножку полипа ножницами или щипцами, проведёнными через операционный канал гистероскопа.
Относительно дальнейшей тактики ведения мнения разных авторов расходятся. Многие авторы считают, что удаления полипа достаточно. Другие считают, что после удаления полипа целесообразно назначить гормональную терапию. Вопрос о необходимости и целесообразности гормональной терапии после полипэктомии до сих пор остаётся спорным. Но подавляющее большинство специалистов считают, что гормональная терапия после удаления полипов показана при железистых полипах функционального типа и аденоматозных полипах, а также при сочетании полипов эндометрия с гиперплазией эндометрия. Виды гормональных препаратов и схемы лечения пациентки после удаления полипов эндометрия зависят от её возраста, характера полипа, выраженности пролиферативных процессов в эндометрии (табл. 24- 1 и 24-2).
ОСТАНОВКА КРОВОТЕЧЕНИЯ
Остановку кровотечения осуществляют путём раздельного диагностического выскабливания слизистой оболочки матки под контролем гистероскопии. Гистероскопия необходима для диагностики внутриматочной патологии (подслизистый узел, аденомиоз), а также для контроля качества удаления всего патологического очага. Традиционно для лечения гиперплазии эндометрия после раздельного диагностического выскабливания матки применяют гормональную терапию.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
ГОРМОНАЛЬНАЯ ТЕРАПИЯ
Гормональное лечение ГПЭ патогенетически обосновано. Гормонотерапия рассчитана на местное действие (подавление пролиферации эндометрия) и центральный эффект (торможение выделения гонадотропных гормонов и стероидогенеза в яичниках).
В настоящее время для лечения ГПЭ применяют нижеследующие группы гормональных препаратов с учётом возраста пациентки и выраженности пролиферации.
Комбинированные соединения ― эстрогенгестагенные препараты (КОК). Предпочтение отдают препаратам, содержащим прогестагены третьего поколения, характеризующиеся более низкой частотой побочных реакций андрогенного типа и не вызывающие метаболических эффектов: марвелон©, мерсилон©, силест©, новинет©, регулон©. Прогестагенные препараты. По классическим представлениям прогестины назначают для лечения гиперплазии эндометрия изза их блокирующего влияния на эпителиальный рост. Они снижают количество эстрогеновых рецепторов и ускоряют их катаболизм, стимулируя 17βгидроксистероиддегидрогеназу и сульфотрансферазу, и, таким образом, снижают доминирование эстрогенов в гормональном фоне, приводящее к гиперплазии эндометрия. Также прогестагены тормозят выделение гонадотропинов.
Следует отметить, что 19норстероиды помимо прогестагенного эффекта обладают андрогенным и анаболическим действием. Длительное их применение может оказывать неблагоприятное воздействие, вызывая появление признаков андрогенизации и метаболические расстройства: увеличение массы тела, нарушения липидного спектра крови и появление гиперинсулинемии. Эти препараты особенно противопоказаны больным с метаболическим синдромом и СПКЯ, поскольку могут усугубить, как правило, уже имеющуюся гиперандрогению и нарушения липидного и углеводного обмена.
Для лечения ГПЭ достаточно широко используют прогестагены, производные прогестерона, не дающие андрогенного эффекта и значительно реже приводящие к развитию метаболических расстройств. К числу этих препаратов относят медроксипрогестерон, мегестрол и гидроксипрогестерона капроат, дезогестрел (чарозетта ©).
Прогестагены, так же как и синтетические эстрогенгестагены, противопоказаны при тромбоэмболических заболеваниях в анамнезе, выраженном варикозном изменении вен голеней и геморроидальных вен, при гепатите и холецистите. Имеются данные о том, что при системном применении прогестагенов могут возникнуть побочные стероидные эффекты: изменение настроения, головная боль, депрессия, увеличение массы тела, кровотечения «отмены». Эти побочные эффекты нередко приводят к отказу пациенток от назначенной терапии.
Вариант гормонотерапии и, по мнению ряда исследователей, хорошая альтернатива хирургическому лечению при маточных кровотечениях ― использование гормонсодержащего ВМК, содержащего левоноргестрел (мирена ©). Согласно обнадёживающим предварительным результатам данного вида лечения, в 80% случаев можно избегать гистерэктомии особенно у пациенток с сочетанной патологией эндо и миометрия (аденомиоз, ГЭ), а также при лечении меноррагии у пациенток перименопаузального периода.
В основе контрацептивных и терапевтических эффектов гормонсодержащего ВМК ― местное воздействие на тканимишени (эндометрий и слизь цервикального канала) и выраженный антипролиферативный эффект на эндометрий. Применение гормонсодержащего ВМК также сопровождается снижением продукции простагландинов, эстрогена и эстроген/прогестерониндуцируемых факторов роста и повышением активности ЦОГ2 и инсулинзависимого фактора роста.
Такой метод лечения позволяет избежать метаболизма прогестагенов через печень, к тому же действие гормонального препарата на местном уровне не вызывает побочных эффектов, свойственных прогестагенам. Единственный побочный эффект ― резкое снижение менструальных кровотечений до 82–96% в течение года. Аменорея или гипоменоррея наступает у 65% женщин, использующих гормонсодержащую ВМК.
После окончания лечения в 36% случаев отмечают рецидивы заболевания. И всё же при отсутствии воспалительных изменений слизистой оболочки матки такой путь введения прогестагенов достаточно перспективен, особенно у пациенток с метаболическим синдромом.
Наряду с прогестагенами для лечения гиперплазии эндометрия широко и эффективно используют препараты с выраженным антигонадотропным действием, такие как даназол (производное 17этинилтестостерона) и гестринон (производное 19норстероидов).
Антигонадотропный эффект этих препаратов выражается в снижении уровней ЛГ и ФСГ, уменьшении синтеза половых стероидов в яичниках и атрофии эндометрия. По данным различных авторов, шестимесячный курс терапии даназолом сопровождается нормализацией состояния эндометрия у 71–95,9% пациенток. Даназол и гестринон ― производные андрогенов, в связи с чем они, помимо основного антигонадотропного действия, обладают андрогенной активностью. Это связано в первую очередь с тем, что один из наиболее активных метаболитов даназола ― этинилтестостерон ― сам обладает свойствами андрогена, а также способствует увеличению содержания свободного тестостерона в сыворотке крови. Андрогенная и метаболическая активность даназола и гестринона вызывает достаточное количество побочных эффектов: прибавку массы тела, появление акне, себореи, гирсутизма. Известно также их неблагоприятное влияние на функцию печени. Побочные действия этих препаратов в значительной степени ограничивают их использование у больных с гиперандрогенией и метаболическими нарушениями.
В последние десятилетия в гинекологии стали широко использовать агонисты ГнРГ для лечения различных гормонзависимых заболеваний. Среди препаратов данной группы наиболее широко распространены гозерелин, трипторелин, бусерелин в двух формах: эндоназальный спрeй и инъекции депопрепарата. С середины 1990х гг. появились работы о применении аналогов ГнРГ при лечении маточных кровотечений и гиперплазии эндометрия. Эффективность терапии аналогами ГнРГ оказалась достаточно высокой (83–93,3%) и продолжается длительное время. Положительный эффект терапии этими препаратами достигается благодаря блокаде ими гипофизарнояичниковой системы и их прямого влияния на клеткимишени. К тому же, в противоположность даназолу и гестринону, агонисты ГнРГ не оказывают неблагоприятное влияние на метаболические процессы и, в частности, на липидный спектр крови и резистентность к инсулину. Применение агонистов ГнРГ приводит к гипоэстрогении, наступлению псевдоменопаузы, сопровождающейся рядом побочных симптомов, характерных для климактерического синдрома. Ввиду возможных тяжёлых побочных эффектов агонистов ГнРГ, в особенности на костную систему, приём их ограничен 6 месяцами.
Отношение к антиэстрогенам (тамоксифену) при лечении гиперплазии эндометрия неоднозначно. Селективный модулятор ЭР, тамоксифен способен регулировать содержание рецепторов к гормонам в ткани эндометрия и обеспечивать эффект при последующем применении гестагенов. Для лечения гиперплазии эндометрия, в том числе и рецидивирующей, тамоксифен назначают вместе с гестагенами или предварительно. Однако до сих пор остаётся спорной не только эффективность тамоксифена при гиперплазии эндометрия, но и целесообразность его назначения, так как с середины 1990х гг. появилось много публикаций о повышении риска возникновения патологии эндометрия при длительном применении тамоксифена у больных раком молочной железы. Выбор гормонального препарата для лечения гиперплазии эндометрия, схемы и длительность лечения зависят от характера патологии эндометрия и возраста пациентки.
ГОРМОНАЛЬНОЕ ЛЕЧЕНИЕ ПАЦИЕНТОК В РЕПРОДУКТИВНОМ ВОЗРАСТЕ
яичниках (абсолютная или относительная гиперэстрогения). Пациенткам с относительной гиперэстрогенией целесообразно назначать КОК, а с абсолютной ― гестагены и другие препараты.
При простой гиперплазии в молодом возрасте возможно ежемесячное использование медроксипрогестерона в дозе 10– 20 мг курсами по 10–14 дней в течение 3–6 мес с последующим контрольным исследованием эндометрия. В случае отсутствия эффекта от терапии прогестагены назначают в более высоких дозах в непрерывном режиме по схемам, применяющихся для лечения атипической гиперплазии эндометрия.
Женщинам репродуктивного возраста, нуждающимся в контрацепции, а также тем, кому противопоказана системная гормональная терапия и не показана гистерэктомия, наиболее целесообразно применять гормонсодержащий ВМК для местного лечения гиперплазии эндометрия.
Схемы и виды гормональных препаратов для лечения гиперплазии эндометрия без атипии в репродуктивном возрасте представлены в табл. 24-1.
Диспансерное наблюдение: не менее года стойкой нормализации менструального цикла.
С целью формирования овуляторного менструального цикла у женщин репродуктивного возраста в дальнейшем показано применение стимуляторов овуляции (кломифен от 50 до 150 мг в день с 5го по 9й день цикла в течение 3 мес). После нормализации менструального цикла лечение прекращают. Диспансерное наблюдение составляет 12–24 мес.
Таблица 24-1. Гормональное лечение гиперплазии эндометрия без атипии в репродуктивном возрасте
| Препарат | Суточная доза | Режим введения | Длительность лечения* |
| Норэтистерон | 5–10 мг | С 16-го по 25-й день цикла | 6 мес |
| Дидрогестерон | 10 мг | С 16-го по 25-й день цикла | 3–6 мес |
| Гидроксипрогестерона капроат | 250 мг внутримышечно | 14-й и 21-й дни цикла | 3–6 мес |
| Медроксипрогестерон | 200 мг | 14-й и 21-й дни цикла | 3–6 мес |
| КОК | 1 таблетка | По контрацептивной схеме | 3–6 мес |
Примечание. * Контроль эффективности: УЗИ через 3, 6, 12 мес; аспирационная биопсия или контрольная гистероскопия с раздельным диагностическим выскабливанием через 6 мес.
Рецидивирование ГПЭ чаще свидетельствует о недостаточной терапии либо о гормонально активных структурах в яичниках. Это требует уточнения состояния яичников с помощью эндоскопической биопсии или резекции яичников при лапароскопии. Отсутствие морфологических изменений в яичниках позволяет продолжить гормональную терапию более высокими дозами препаратов. Гиперплазия эндометрия и неэффективность гормонотерапии могут быть обусловлены наличием инфекций, поэтому этим пациенткам показано обследование на все виды инфекций.
При рецидиве гиперплазии эндометрия пациенткам позднего репродуктивного периода, реализовавшим репродуктивную функцию, показана аблация эндометрия (баллонная, электрохирургическая, лазерная).
При сочетании гиперплазии эндометрия с выраженным аденомиозом или ММ с центропитальным ростом вопрос о тактике ведения решают в пользу гистерэктомии.
ГОРМОНАЛЬНОЕ ЛЕЧЕНИЕ ПАЦИЕНТОК ПЕРИОДА ПРЕ И ПЕРИМЕНОПАУЗЫ
Гормональная терапия в перименопаузе предполагает применение препаратов, так или иначе подавляющих продукцию эстрогенов и митотическую активность эндометриальных клеток: прогестагены, антигонадотропины и агонисты ГнРГ (табл. 24-2). Подбор вида гормонального препарата для пациенток перименопаузального периода затруднён, так как гормональное лечение часто является абсолютным или относительным противопоказанием в связи с высокой частотой экстрагенитальных заболеваний нейрообменноэндокринного характера.
Таблица 24-2. Гормональное лечение гиперплазии эндометрия без атипии и полипов эндометрия в периоде пре- и перименопаузы
| Препарат | Доза | Режим введения | Длительность лечения* |
| Норэтистерон | 10 мг в сутки | С 5-го по 25-й день, возможно с 16-го по 25-й день цикла | 6 мес |
| Гидроксипрогестерона капроат | 250 мг внутримышечно | 14-й и 21-й дни цикла или 2 раза в неделю | 6 мес |
| Медроксипрогестерон | 200 мг | 1 раз в неделю | 6 мес |
| Бусерелин (эндоназальный спрей) | 0,9 мг в сутки | 3 раза в день | 6 мес |
| Гозерелин, трипторелин, бусерелин (депо-форма) | 3,6 мг подкожно | 1 раз в 28 дней | 3–4 инъекции |
Примечание. Контроль эффективности: УЗИ через 3, 6, 12 мес, аспирационная биопсия через 3 мес, контрольная гистероскопия с раздельным диагностическим выскабливанием через 6 мес.
Диспансерное наблюдение: не менее 1 года стойкой нормализации менструального цикла или стойкой постменопаузы.
Гормональная терапия гиперплазии эндометрия без атипии предусматривает назначение прогестагенов (например, дезогестрела [чарозетта©]) по схеме контрацепции или в непрерывном режиме (для прекращения менструаций). Антиэстрогены (тамоксифен) и андрогены не нашли широкого применения при лечении ГПЭ, хотя их назначение не исключено.
Рецидив ГПЭ, а также сочетание этой патологии с ММ или внутренним эндометриозом у больных периода пре и перименопаузы требует расширения показаний к оперативному вмешательству.
ГОРМОНАЛЬНОЕ ЛЕЧЕНИЕ В ПОСТМЕНОПАУЗЕ
Большинство авторов сходятся во мнении, что при впервые обнаруженной гиперплазии эндометрия без атипии у женщин в постменопаузе и при тяжёлой соматической патологии возможно назначение гормональной терапии пролонгированными гестагенами (гидроксипрогестерона капроат, медроксипрогестерон) в непрерывном режиме на 8–12 мес или агонистами ГнРГ (бусерелин) в течение 6–8 мес параллельно с гепатопротекторами, антикоагулянтами, антиагрегантами. Допустима аблация эндометрия. Лечение должно быть обеспечено УЗИ и цитологическим контролем, по показаниям ― раздельное диагностическое выскабливание слизистой оболочки матки под контролем гистероскопии.
При рецидиве гиперплазии эндометрия в постменопаузе несомненно показано хирургическое вмешательство ― экстирпация матки с придатками.
Отдельно следует остановиться на тактике ведения пациентов с доброкачественными гиперпластическими процессами на фоне атрофического эндометрия, характерных для пациенток глубокого постменопаузального возраста. Есть все основания говорить о том, что гиперпластический процесс (гиперплазия, полип эндометрия) возник на фоне возрастного воспалительного процесса, связанного с глубокой гипоэстрогенемией. В подобной ситуации рекомендуется проводить короткий курс гормонотерапии. Это либо КОК по 1/2 таблетки в течение 3 мес, либо препараты ЗГТ также в течение 3 мес с обязательным последующим гистероскопическим и гистологическим контролем. Подобная тактика даёт положительные результаты почти в 95% случаев.
ГОРМОНАЛЬНОЕ ЛЕЧЕНИЕ АТИПИЧЕСКОЙ ГИПЕРПЛАЗИИ ЭНДОМЕТРИЯ
У женщин периода пре и постменопаузы при наличии гиперплазии эндометрия с атипией предпочтительным остаётся радикальное хирургическое вмешательство (экстирпация матки). Вопрос об удалении яичников каждый раз решают индивидуально, это определяется состоянием яичников, а также отношением пациентки к их удалению, выраженностью экстрагенитальной патологии.
С появлением высокоэффективных синтетических гормональных препаратов стало возможным у пациенток молодого возраста лечить консервативно не только гиперплазию эндометрия с атипией, но также и начальные формы рака эндометрия.
При гормонотерапии атипической гиперплазии эндометрия в основном используют три группы препаратов: гестагены (гидроксипрогестерона капроат, медроксипрогестерон и др.), антигонадотропины (даназол, гестринон) и агонисты ГнРГ (гозерелин, трипторелин, бусерелин и др.).
Результаты гормонотерапии атипической гиперплазии эндометрия зависят от характера атипии и патогенетического варианта заболевания. Лечение прогестинами более эффективно при структурной атипии, чем при клеточной атипии.
Гормонотерапия практически неэффективна при сочетании атипической гиперплазии эндометрия с патологией миометрия и яичников.
При лечении атипической гиперплазии эндометрия рекомендуют добавление небольших доз эстрогенов в сочетании с прогестинами (как при ЗГТ) или использование медроксипрогестерона параллельно с агонистами ГнРГ. Дополнительная терапия полезна тем, что увеличивает приемлемость терапии агонистами ГнРГ и позволяет её использовать более долгое время.
При выборе у больных с атипической гиперплазией эндометрия для назначения самостоятельной гормонотерапии надо быть крайне осторожными, необходимо учитывать медицинские и социальные критерии. К медицинским критериям относится квалифицированное морфологическое заключение о наличии гиперплазии эндометрия с атипией и её степени.
Морфологическая диагностика предрака и начального рака эндометрия трудна, особенно в репродуктивном возрасте, имеет большое число диагностических ошибок. Вследствие этого необходима консультация опытных морфологов по гистологическим препаратам. К социальным критериям относятся: возраст, желание женщины сохранить матку и получение информированного согласия пациентки на соответствующее лечение.
Органосохраняющее лечение (гормонотерапия) должно быть обеспечено строгим динамическим наблюдением. Кюретаж (желательно под контролем гистероскопии) показан через 2 мес на фоне лечения и после окончания его. Метод аспирационной биопсии в данном контингенте больных малоинформативен, так как позволяет получить для исследования лишь клетки поверхностного слоя эндометрия.
Критерием выздоровления при гормональной терапии считают достижение атрофии эндометрия. Далее необходим реабилитационный этап лечения, направленный на восстановление функциональной способности эндометрия. На этом этапе вводят комбинированные эстрогенгестагенные препараты на протяжении 6 мес по контрацептивной схеме. После окончания гормональной терапии вновь рекомендуют раздельное диагностическое выскабливание слизистой оболочки матки под контролем гистероскопии.
После прекращения гормонотерапии у пациенток репродуктивного возраста необходимо следить за восстановлением спонтанной овуляции. При ановуляторных циклах риск рецидива заболевания высок. В связи с этим при отсутствии овуляции у пациенток репродуктивного возраста рекомендуют стимуляцию овуляции путём приёма гормональных препаратов (кломифена), а при их неэффективности ― посредством хирургического вмешательства (у больных с СПКЯ). Гиперплазия с атипией в перименопаузе требует назначения более высоких доз парентеральных гестагенов или агонистов ГнРГ.
Контроль за результатом лечения осуществляют через 3 и 6 мес с помощью цитологического исследования аспирата из полости матки, УЗИ. Через 6 мес показано раздельное диагностическое выскабливание слизистой оболочки матки под контролем гистероскопии. Наступление стойкой постменопаузы считают прогностически благоприятным фактором.
Диспансерное наблюдение за пациентками осуществляют в течение 12–24 мес динамическим скринингконтролем с применением УЗИ.
Схемы гормональной терапии атипической гиперплазии эндометрия представлены в таблицах 24-3 и 24-4.
Таблица 24-3. Гормональное лечение атипической гиперплазии эндометрия у пациенток репродуктивного возраста
| Препарат | Доза | Ритм введения | Длительность лечения* |
| Гидроксипрогестерона капроат, медроксипрогестерон | 500 мг внутримышечно | 2 мес: 3 раза в неделю; 2 мес: 2 раза в неделю; 2 мес: 1 раз в неделю | 6 мес |
| Бусерелин (эндоназальный спрей) | 0,9 мг в сутки | 3 раза в день | 6 мес |
| Гозерелин, трипторелин, бусерелин (депо-форма) | 3,6 мг подкожно | 1 раз в 28 дней | 3 инъекции |
Примечание. * Контроль эффективности: УЗИ через 1, 3, 6, 12 мес. Раздельное диагностическое выскабливание под контролем гистероскопии через 2 и 6 мес. Диспансерное наблюдение: не менее 1 года стойкой нормализации менструального цикла.
Таблица 24-4. Гормональное лечение атипической гиперплазии эндометрия у пациенток в периоде пре- и перименопаузы
| Препарат | Доза | Ритм введения | Длительность лечения* |
| Гидроксипрогестерона капроат | 500 мг внутримышечно | 2 раза в неделю | 6–9 мес |
| Медроксипрогестерон | 400–600 мг внутримышечно | 1 раз в неделю | 6–9 мес |
| Гестринон | 2,5 мг | 2–3 раза в неделю | 6–9 мес |
| Бусерелин (эндоназальный спрей) | 0,9 мг в сутки | 3 раза в день (0,9 мг в сутки) | 6 мес |
| Гозерелин, трипторелин, бусерелин (депо- форма) | 3,6 мг подкожно | 1 раз в 28 дней | 4–6 инъекций |
Примечание. *Контроль эффективности: УЗИ через 3, 6, 12 мес. Аспирационная биопсия эндометрия через 2–3 мес.
Раздельное диагностическое выскабливание и гистероскопия через 6 мес. Диспансерное наблюдение: не менее 2 лет стойкой нормализации менструального цикла либо стойкой постменопаузы.
Повторное возникновение атипической гиперплазии эндометрия или аденоматозных полипов эндометрия, несмотря на адекватную гормональную терапию, требует расширения показаний к оперативному лечению (экстирпация матки).
Рецидив гиперплазии эндометрия с атипией в периоде пре и перименопаузы — показание к пангистерэктомии.
НЕГОРМОНАЛЬНОЕ МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ ГИПЕРПЛАСТИЧЕСКИХ ПРОЦЕССОВ ЭНДОМЕТРИЯ
Учитывая сложные патогенетические механизмы гиперплазии эндометрия, многие авторы считают, что, помимо гормональной терапии, в комплекс лечения больных с гиперплазией эндометрия по показаниям следует включать диету с пониженным содержанием жиров, углеводов и жидкости; препараты, способствующие коррекции обменноэндокринных нарушений (метионин, линетол, холина хлорид) и нормализующие водноэлектролитный обмен (спиронолактон, гидро- хлоротиазид+триамтерен, калия и магния аспарагинат); средства, улучшающие состояние центральной нервной системы (циннаризин, винпоцетин, пирацетам, беллоид©); витамины; иммуномодуляторы; лечебнооздоровительные мероприятия; седативные препараты.
При сопутствующих ВЗОМТ проводят комплексную противовоспалительную терапию.
Профилактически, с целью устранения отрицательного действия гормональных препаратов на гемореологические свойства крови и гепатобилиарную систему, пациенткам, получающим гормональное лечение, показаны дезагреганты (ацетилсалициловая кислота), гепатопротекторы и средства, улучшающие функцию пищеварения (фестал©, фосфолипиды, силибинин, аллохол©, панкреатин, травяные сборы, минеральные воды).
Несмотря на прогресс современной фармакологии, наряду с большим числом побочных эффектов, достаточно часто встречаются случаи резистентности к гормональной терапии, неполного или временного эффекта от лечения, возникновения рецидивов. Так, частота рецидивов гиперплазии эндометрия после гормонального лечения остаётся достаточно высокой и колеблется от 2,5 до 58%.
Основную причину неудач гормональной терапии видят в наличии сопутствующей патологии яичников и нейроэндокринных расстройств с нарушениями обмена веществ. Чем выше их частота, тем чаще проводимое лечение неэффективно.
Известно, что эффективность гормонального лечения коррелирует с наличием и уровнем концентрации ЭР и ПР в гиперплазированном эндометрии: чем выше уровень их содержания, тем успешнее лечение. Частые выскабливания матки могут привести к локальному повреждению рецепторного аппарата эндометрия и, как следствие, ухудшению результатов гормональной терапии. Отмечают взаимосвязь эффективности консервативного лечения со степенью пролиферативной активности эндометрия, определяемой при морфоденситометрическом анализе интерфазного хроматина. Высокая степень пролиферативной активности коррелирует с неэффективностью лечения, более частыми рецидивами и прогрессированием патологического процесса.
Сочетанная патология эндометрия и миометрия также может быть одной из причин неэффективности гормонального лечения. Гиперплазия эндометрия сочетается с ММ в 25–30,8%, с аденомиозом ― в 12,5–34,8% случаев.
Ухудшение индекса здоровья населения в современных условиях значительно затрудняет выбор препаратов для гормональной терапии изза большого числа сопутствующих экстрагенитальных заболеваний, особенно в периоды пре и постменопаузы. Лечение гормонами противопоказано при таких экстрагенитальных заболеваниях, как стенокардия, артериальная гипертензия, инфаркт миокарда и нарушения кровообращения (в анамнезе), тромбофлебиты и тромбоэмболические состояния (в анамнезе), узловая мастопатия и рак молочной железы, злокачественные образования щитовидной железы, язвенная болезнь желудка и двенадцатиперстной кишки, хронический холецистопанкреатит.
Противопоказанием также является состояние после холецистэктомии.
Не следует забывать и о высокой стоимости гормональных препаратов, обусловливающей не только медицинские, но и социальные аспекты выбора приемлемого метода лечения гиперплазии эндометрия.
В связи с этим при неэффективности гормональной терапии или при наличии противопоказаний к ней и невозможности её проведения методом выбора для больных с ГПЭ, особенно в сочетании с ММ или аденомиозом, а также в периоды пре и постменопаузы, до недавнего времени считали хирургическое лечение в объёме гистерэктомии (лапароскопическим или лапаротомическим доступом).
Гистерэктомия может привести ко многим психологическим и физическим изменениям женщины, снижению функции яичников, нарушениям в мочеиспускании, психоэмоциональным расстройствам, угнетению сексуальной функции женщины.
Отрицательные стороны гистерэктомии и бурное развитие эндоскопической хирургии привели к поиску малоинвазивных негормональных методов лечения гиперплазии эндометрия.
Методы термического воздействия на эндометрий (аблация эндометрия) Аблация эндометрия может быть выполнена гистероскопическими и негистероскопическими методиками (см. раздел «Гистероскопические операции»).
Показания к аблации эндометрия при гиперпластических процессах эндометрия:
- рецидивирующие гиперпластические процессы эндометрия без атипии;
- отказ пациентки от гормональной терапии;
- невозможность проведения гормональной терапии;
- риск для жизни гистерэктомии (при показании к ней).
Перед всеми видами аблации эндометрия необходимо исключить рак эндометрия, т.е. выполнить гистологическое исследование слизистой оболочки матки. Желательна предварительная гистероскопия с целью исключения органической внутриматочной патологии.
На сегодняшний день мнение о возможности применения аблации эндометрия при предраковых и раковых состояниях неоднозначно. Только единичные авторы считают возможным применение аблации эндометрия при атипической гиперплазии, аденоматозных полипах и даже раке эндометрия. Однако это касается небольшого числа больных, чаще с сопутствующей экстрагенитальной патологией.
И всё же подавляющее большинство эндоскопистов наличие атипической гиперплазии эндометрия рассматривают как противопоказание для аблации эндометрия. Такое заключение основывается на исследованиях, доказывающих, что даже опытный эндоскопист не в состоянии полностью удалить весь эндометрий.
При подборе пациенток для аблации эндометрия необходимо учитывать ряд факторов: нежелание женщины в дальнейшем беременеть, отказ от гистерэктомии и желание сохранить матку, риск для чревосечения и величина матки, не превышающая (по данным разных авторов) 10–12 нед. Наличие миомы не препятствует проведению аблации (резекции) эндометрия, но при условии, что ни один из узлов не превышает 4–5 см.
Аблацию эндометрия можно проводить при наличии аденомиоза, но он ухудшает результаты операции.
Общепризнанные противопоказания к аблации эндометрия ― злокачественные поражения внутренних половых органов, а также пролапс матки.
Перед выполнением аблации эндометрия в первую очередь необходимо петлевым электродом под контролем гистероскопии иссечь полипы или миоматозные узлы, если они есть. Эти удалённые ткани необходимо отдельно отправить на гистологическое исследование. И только после этого начинают собственно аблацию (резекцию) эндометрия.
Гистероскопические методы аблации эндометрия могут быть электрохирургические или лазерные.
При электрохирургической аблации эндометрия используют одну из следующих методик.
- Аблация эндометрия шаровым или цилиндрическим электродом.
- Резекция эндометрия петлевым электродом.
- Комбинированный метод: проводится резекция эндометрия в сочетании с шаровой аблацией эндометрия.
Преимущество петлевой резекции эндометрия:
- Эндометрий иссекают со всех отделов матки и подвергают гистологическому исследованию. Это минимизирует риск пропуска или запоздалой диагностики патологии эндометрия на изолированных участках.
- Гормональная предоперационная подготовка не так важна, как при других методах, что снижает стоимость процедуры и позволяет избежать побочных эффектов препаратов.
- Возможно излечение поверхностного аденомиоза, так как иссекают часть миометрия.
- Для пациенток, желающих сохранить менструацию, возможно выполнение частичной резекции эндометрия или сохранение эндометрия в нижнем сегменте полости матки.
- Субмукозные миоматозные узлы, полипы эндометрия, неожиданно обнаруженные, могут быть одновременно удалены без необходимости отмены процедуры или смены инструментов.
Однако есть и отрицательные стороны (недостатки) петлевой резекции эндометрия: большая сложность техники операции, возможность травматических и ожоговых осложнений, и, самое важное, результат операции зависит от опыта хирурга в оперативной гистероскопии и понимания им анатомии матки.
При этом электрохирургическая аблация эндометрия имеет преимущества перед лазерной в стоимости при одинаковой эффективности. К тому же абсорбция жидкости значительно выше и чаще происходит при лазерной аблации эндометрия, возможно, вследствие большей длительности операции. Недостаток лазерной аблации эндометрия, так же как и шаровой, ― отсутствие материала для гистологического исследования. К тому же при аблации эндометрия при помощи NdYAGлазера требуется защита глаз хирурга от возможного повреждения лазерным лучом, и многие авторы это расценивают как недостаток метода.
Несмотря на высокую эффективность и безопасность метода, при гистероскопической аблации эндометрия всё же имеются осложнения от 1 до 12%, в среднем 6–7%. При этом шаровая аблация и лазерная аблация эндометрия обладают меньшим числом осложнений, чем петлевая резекция эндометрия.
Под эффективностью операции аблации эндометрия прежде всего подразумевают отсутствие маточных кровотечений и рецидива гиперпластических процессов эндометрия. При этом у пациенток могут отмечать и аменорею, и гипоменорею, и эуменорею ― всё это показатели эффективности операции.
Эффект, достигнутый гистероскопической аблацией эндометрия, поддерживается в течение 1–2 лет примерно у 80–85% оперированных. После операции аблации (резекции) эндометрия, как электрохирургической, так и лазерной, полная аменорея возникает примерно в 25–60% случаев. Рецидивы маточных кровотечений возникают у 8–32%, при этом основная часть неудачных результатов выявляется в первые 14–18 мес после операции. Процент неэффективности процедуры увеличивается от 13% через 2 года до 27% через 5 лет после операции, при этом частота гистерэктомии составляет 11,6% у подавляющего большинства эндоскопистов, влияют возраст пациентки и величина полости матки, наличие аденомиоза, дисменореи.
Гистероскопические методы аблации эндометрия требуют общей или эпидуральной анестезии. Исход процедуры напрямую зависит от квалификации оперирующего хирурга. Меньшая травматичность этих процедур не требует госпитализации пациентки на несколько дней, а период выздоровления не растягивается на несколько недель. На современном этапе в России из методик аблации эндометрия второго поколения доступна баллонная аблация эндометрия по системе «ThermaChoice». Многочисленные исследования подтверждают данные об эффективности этого способа лечения ГПЭ и маточных кровотечений (от 77 до 94%). Большинство авторов признают доступность, простоту исполнения и безопасность этого метода.
Однако существуют важное ограничение и недостаток использования внутриматочных баллонов ― невозможность применения при дефектах миометрия, кесаревом сечении или миомэктомии в анамнезе, а по мнению некоторых авторов, и при деформации полости матки за счёт подслизистых миоматозных узлов.
Несмотря на простоту использования, этот метод аблации эндометрия также не лишён возможных интра и послеоперационных осложнений.
К недостаткам баллонной аблации эндометрия можно также отнести то, что при операции используют одноразовый аппликатор, что повышает стоимость операции для пациентки.
Существуют определённые обязательные условия и ограничения для применения методик аблации эндометрия второго поколения.
- Предварительная гистероскопия.
- Доброкачественный характер патологии эндометрия.
- Длина матки по зонду от 4 до 12 см.
- Отсутствие субмукозной миомы, перегородки в матке, ВМК.
- Предоперационная гормональная подготовка или кюретаж слизистой оболочки матки.
- Отсутствие заинтересованности менструирующей пациентки в репродуктивной функции.
Таким образом, аблация эндометрия, предложенная как альтернатива гистерэктомии у пациенток с маточными кровотечениями, эффективна для лечения женщин с гиперплазией эндометрия. Основное преимущество аблации эндометрия ― сохранение здоровых тканей матки при радикальном воздействии на патологически изменённые ткани эндометрия.
ПРИМЕРНЫЕ СРОКИ НЕТРУДОСПОСОБНОСТИ
Гормонотерапия не накладывает ограничений на трудоспособность больных, после гистероскопии к труду можно приступать на 2–3й день.
После аблации эндометрия пациентки, занятые умственным трудом, могут приступать к работе через 7 дней. К тяжёлому физическому труду больные могут вернуться не ранее чем через 21 день после аблации.
Сроки восстановления трудоспособности после гистэрктомии стандартные (3–4 нед) и во многом зависят от доступа операции (лапароскопический, лапаротомический, вагинальный), осложнений послеоперационного периода, декомпенсации соматических заболеваний.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
При назначении гормонотерапии целесообразно разъяснить больной ожидаемую эффективность, возможные осложнения и побочные эффекты, методы их предотвращения.
При аблации эндометрия больной разъясняют преимущества метода, известную эффективность, возможные осложнения.
Больная должна быть информирована, что аблация эндометрия не предотвращает наступление маточной или внематочной беременности в репродуктивном возрасте, при этом вынашивание беременности невозможно, необходимо её прерывание. Следует также информировать пациентку об особенностях послеоперационного течения: характерны тянущие боли в низу живота, небольшой субфибрилитет, сукровичные, кровяные и водянистые выделения из половых путей на протяжении 4 нед.
ПРОГНОЗ
При дифференцированном выборе метода лечения и адекватном диспансерном наблюдении у всех больных с ГПЭ можно предотвратить возникновение рака эндометрия.

